16/03/2010
Eziquiel Menta
| Modalidad / Nivel de Enseñanza | Disciplina | Tema |
|---|---|---|
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
O que o aluno poderá aprender com esta aula
O fenômeno da eletrólise é basicamente contrário ao da pilha, pois, o processo químico da pilha é espontâneo, e o da eletrólise é um processo não espontâneo que é provocado pela corrente elétrica.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Eletroquímica
- Pilhas de Daniell
- Ordem Crescente de ação oxidante
- Pilhas Alcalinas
- Pilhas de Mercúrio
Estratégias e recursos da aula
Momento - 01
Olá Professor !
Inicie a aula problematizando a seguinte questão com os alunos:

É muito comum as pessoas fazerem confusão entre as polaridades de pilhas e eletrólises, principalmente poque esse tipo de análise exige um conhecimento prévio sobre circuitos elétricos. A eletrólise seria um processo artificial ou natural, ou qual seria o esquema geral da eletrólise.

Eletrólise Ígnea
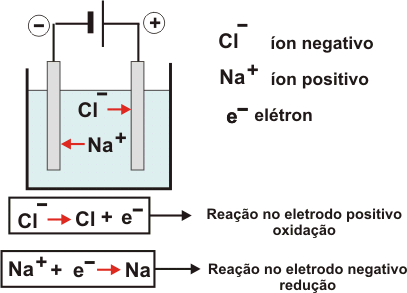
Fonte: http://alfaconnection.net/images/FQM030108a.gif acessado 10/02/2010
Eletrólise Aquosa
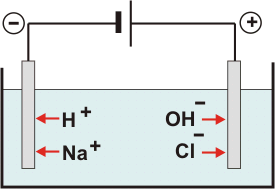
Fonte: http://alfaconnection.net/pag_avsf/fqm0302.htm acessado 10/02/2010

A pilha produz energia elétrica a partir de uma reação espontânea de oxirredução. Na verdade o processo inverso, em que a energia elétrica pode originar um processo de oxirredução, denominamos de eletrólise. A eletrólise é um processo artificial, que não ocorre naturalmente, mas que possui grande importância prática. Ocorre a produção de vários metais, os recobrimentos (como a cromagem e a niquelação) e as recargas de baterias são algumas das muitas aplicações da eletrólise.
Mas qual seria o esquema geral da eletrólise? Sabemos que substâncias iônicas conduzem corrente elétrica quando fundidas ou em soluções aquosas. O que notaremos que agora a condução de corrente elétrica se dá pela formação de substâncias nos eletrodos. Quando ocorre a passagem da corrente elétrica em uma substância iônica no estado de fusão, a eletrólise denomina-se ígnea. Mas, se a substância iônica estiver dissolvida em água, será chamada de eletrólise aquosa.

Gerador x Receptor
Várias pessoas confundem as polaridades de pilhas e eletrólises, principalmente porque esse estudo exige algum conhecimento de circuitos elétricos. Em eletricidade, aprendemos que gerador é na verdade um sistema que transforma algum tipo de energia em energia elétrica. Assim, uma pilha é um gerador em que a energia potencial química é transformada em energia elétrica. E o receptor faz exatamente ao contrário, ou seja, um ventilador, por exemplo, transforma energia elétrica em energia mecânica.
Eletrólise Ígnea
&nbs p; E letrólise ígnea é a eletrólise de um ele trólito no estado fu ndido. Nela, o sólido iônico deve ser liqu efeito por aquecimen to (fusão), pois assim os íons têm livre movimento, podendo se deslocar até os eletrodos e aí se descarregarem (fanhar ou perder elétrons).
Eletrólise Aquosa
Vamos considerar uma solução aquosa de NaCl. Quais íons estarão presentes?
É claro que Na+ e Cl- são os primeiros que imaginamos, mas você não deve se esquecer dos íons H+ e OH- produzidos pela auto-ionização da água. Dos íons derivados da água, apesar de estarem em pequena quantidade, são importantes para que possamos entender o mecanismo das eletrólises aquosas. Em experiências diversas, grandes cientistas verificaram que os íons Na+ não reagiam em eletrólises aquosas. Procuraram, então, determinar quais íons participavam e quais ficavam apenas como espectadores nessas eletrólises.

Prevendo Semi-Reações de Eletrólise
Nos tipos de eletrólises mais comum, você poderá prever a grande maioria das semi-reações, basta apenas seguir alguns tipos de procedimentos.
- Escreva todos os íons presentes.
- Consulte as listas de facilidades de descarga.
- Observe que os cátions ficarão neutros.
- Note que os ânions também ficarão neutros.

Agora é um momento muito importante para todos nós, porque colocaremos em prática tudo o que aprendemos em nossa aula. Por isso convido a todos vocês a participarem do nosso Blog da Eletrólise. Entre no link abaixo e participe junto aos seus colegas, sobre os questionamentos feitos no Blog. A particpação de todos é muito importante para a aprendizagem de todos os particpantes envolvidos. Aguardo a colaboração de todos vocês.
link: http://fenomenodaeletrolise.blogspot.com/ 2010/03/eletrolise.html

SARDELLA, Antonio; Curso Completo de Química. São Paulo: Editora Ática, 2º Edição 1999
LEMBO; Química Reali dade e Contexto. São Paulo: Editora Ática, 1º Edicação / 6º Impressão 2004
Atkins, P.; Jones, L. Princípios de química: questionando a vida moderna e o meio ambiente. Editora Bookman, 2 001.
Animação / Simulação
a) Demonstrar a aplicação das leis de Faraday no processo de eletrólise de soluções aquosas
b) Demonstrar o processo de eletrólise de soluções aquosas
 Elet rólise do ácido sulfú rico
Elet rólise do ácido sulfú rico
c) Demonstrar aos alunos a técnica de galvanoplastia, utilizado industrialmente para proteger peças de aços da corrosão
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Eletrólise do ácido sulfúrico | Animação/simulação |
| Eletrólise e banho de metais | Experimento prático |
Recursos Complementares

1) Neste vídeo você poderá acompanhar a Eletrólise da Água.
Fonte: Youtube http://www.youtube.com/watch?v=Xey-BxG1tww acessado 10/02/2010
Avaliação
1) Quais são os principais produtos da eletrólise em uma solução aquosa de Ca(NO3)2?
2) Realize à prática no laboratório de química com seus alunos, fazendo a Eletrólise do Ácido Sulfúrico, que tem como objetivo de demonstrar a eletrólise em solução aquosa.
Fonte: Banco Internacional de Objetos Educacionais http://objetoseducacionais2.mec.gov.br/handle/mec/8304 acessado 02/03/2010
Quatro estrelas 2 calificaciones
- Cinco estrelas 1/2 - 50%
- Quatro estrelas 0/2 - 0%
- Três estrelas 1/2 - 50%
- Duas estrelas 0/2 - 0%
- Uma estrela 0/2 - 0%
Denuncia opiniones o materiales indebidos!
Opiniones
-
leandro, ueap , Amapá - dijo:
leandrolqu@hotmail.com04/06/2014
Três estrelasboa explicação
-
RAIANE RODRIGUES SANTOS, EMEFM MAGDALENA TAGLIAFERRO , Rondônia - dijo:
rhay-sou-eu@hotmail.com19/04/2011
Cinco estrelasgostei muitissimo obrigada me ajdou bastante bjs
- Sugerencias de clases
- Clases
- Colecciones de clases
- Crear clase
- Crear individual
- Crear em equipo
- Accede tus equipos
- Mis clases
- Orientaciones
- Creando equipos
- Pistas para producción de clases
- Reflexiones pedagógicas
- Utilizando la herramienta
- Artículo: portal educacional
- Estadísticas de uso del Portal
- Clases Estadísticas
- Estadísticas de recursos
- Estadísticas de visitas
- Recursos utilizados en las clases de
- Reflexiones pedagógicas
- Informaciones de cursos
- Cursos
- e-Proinfo
- Materiales de curso
- Materiales de estudio
- Artículos y Publicaciones
- Asuntos relevantes
- Opiniones
- Ciencias de la vida cotidiana
- Destaca Internacional
- Consejos prácticos
- La educación profesional y tecnológica
- Entrevistas
- Estrategias pedagógicas
- Las innovaciones tecnológicas
- Los materiales del curso
- Acontecimiento Materiales
- Directrices y directivas
- Parámetros y referencias
- Programas en los vídeos
- Tutoriales
- TVescola
- Cuadernos didáticos
- Colecciones de recursos
- Recursos educacionales
- Sitios temáticos
- Tv escuela en vivo
- Herramienta del portal
- Foro
- Portal em Youtube
- Compartiendo presentaciones
- Herramientas por internet
- Blog
- Compartir videos
- La comunicación en línea
- Crear y compartir presentaciones
- Editar y compartir fotos
- Escritura colaborativa
- Únete a una comunicade
- Hilo
- Organizar y compartir tus favoritos
- Podcast
- Radio / TV y otra universidad
- Redes Sociales
- Robot Ed
PLATAFORMA FREIRE
- Bibliotecas
- Proinfo integrado de capacidad
- cultura
- Diccionarios, traductores y enciclopedias
- La educación inclusiva
- Geoprocessamentos
- La inclusión digital
- Infografía
- Juegos educativos
- Periódicos
- Museos
- Observatorios y planetarios
- Organizaciones gubernamentales
- Las plataformas educativas
- Portales educativos y otros
- MEC Portal
- Profesores Premio de Brasil
- Producciones de los docentes
- Proyectos de Escuelas
- Proyectos innovadores
- Los proyectos sociales y educativos
- Escuela de Radio
- Recursos digitales
- Revistas
- Búsqueda Sitios
- Sitios portal temático y TVescola
- Software de edición y otros
- Software educativo
- Un ordenador por alumno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus



