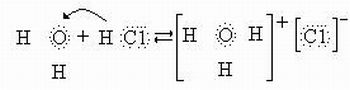26/07/2010
Suelen Fernanda Machado
| Modalidad / Nivel de Enseñanza | Disciplina | Tema |
|---|---|---|
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
O que o aluno poderá aprender com esta aula
Identificar quais as substâncias químicas que possuem a capacidade de sofrer o processo de ionização e volatilização durante o decorrer de uma reação química.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Química Geral
- Química Inorgânica
Estratégias e recursos da aula
Momento 01 -
Professor inicie esta aula questionando o que os alunos já sabem ou ouviram falar sobre o processo de ionização e a volatilização de uma substância. Após dialogarem, proponha que os alunos entrem no recurso do portal abaixo, e respondam as oito questões de química através de um software educacional que possibilita ao aluno exercitar conceitos básicos de química.
Esses exercícios possibilitam que o professor veja e acompanhe o nível em que se encontra seus alunos em relação a aula proposta. A partir desta atividade será possível levantar que conhecimentos possuem sobre o tema.
Professor logo após os alunos responderem as questões, faça um momento de discussão perguntando a eles qual teria sido os argumentos de terem levados a darem esses tipos de respostas. De posse disso, corrija no quadro negro junto com os alunos todas as questões, e ao mesmo tempo em que já entra no conteúdo em si.
Após a prática social inicial realize uma problematização trabalhando a seguinte questão com os alunos:
Que tipo de elementos ou substâncias podem sofrer o processo de ionização? A substância que se ioniza, pode ser ao mesmo tempo volátil?
Professor, para contextualizar a aula, sugerimos a leitura do seguinte texto:
Explicando:
Ionização
A ionização acontece quando uma substância se dissolve e produz uma solução que conduz a corrente elétrica. Formam-se numa reação química entre as moléculas da substância e as moléculas da água. Podemos perceber através das estruturas de Lewis:
Fonte: http://www.brasilescola.com/quimica/ionizacao.htm acessado 03/06/2010
As soluções que conduzem energia são chamadas soluções eletrolíticas e os compostos que em solução aquosa conduzem energia são chamados eletrólitos.
Volatilidade
Líquidos voláteis são materiais muito comuns no cotidiano do estudante. Esses líquidos evaporam com facilidade, sendo alguns deles inflamáveis e outros tóxicos, em graus variados. O cuidado no uso e conservação desses materiais é um importante quesito de segurança no uso das substâncias. Do ponto de vista pedagógico, é fácil, para o professor, recorrer à percepção sensorial do estudante relacionada à evaporação de líquidos. Esse fato propicia uma melhor compreensão do discurso da ciência química relativo às partículas que constituem os materiais e às forças intermoleculares existentes nas diversas substâncias. O ensino da propriedade pressão de vapor ainda provê a possibilidade de aperfeiçoar a compreensão da linguagem gráfica, tão utilizada na comunicação atual. Com o conceito de pressão de vapor, o profesor poderá, por exemplo, explicar o uso da panela de pressão e compreender porque basta usar fogo baixo (economia de energia) após o início da ebulição da água.
Fonte: http://crv.educacao.mg.gov.br/sistema_crv/index.asp?id_projeto=27&ID_OBJETO=42640&tipo=ob&cp=076d54&cb=&n1=&n2=&n3=&n4=&b=s acessado 03/06/2010
Laboratório de Química
Professor separe a sala em cinco grupos para que possa ser realizado no laboratório de química o seguinte experimento prático:
Acesse logo abaixo o recurso do portal para realizar com seus alunos passo a passo, todos os procedimentos do experimento prático do equilíbrio químico da amônia: Efeito do Íon comum.
Neste experimento você terá a possibiidade de visualizar o deslocamento do equilíbrio quimico do íon bicarbonato através da mudança na coloração de uma solução contendo fenolftaleína. Os alunos deverão anotar no caderno todos os procedimentos e resultados durante a aula prática, pois servirão para as demais atividades propostas.
 Equilíbrio Químico da amônia: Efeito do Íon comum: Parte 1: experimento prático
Equilíbrio Químico da amônia: Efeito do Íon comum: Parte 1: experimento prático
- Características do Experimento:
- Material - onde encontrar: em supermercadose farmácias
- Material - quanto custa: acima de 25 reais
- Tempo de apresentação: até 10 minutos
- Dificuldade: fácil
- Segurança: requer cuidados básicos
Professor logo após o término do experimento prático com seus alunos, sugerimos ao(a) professor(a) para que crie o Blog contendo todos os resultados observados durante a aula prática referente ao equilíbrio químico da amônia: efeito do íon comum que foi feito no laboratório de química, para que possa alimentar a discussão, e que efetivamente haja a contribuição e a participação de todos. Pode ser criado apenas um blog para toda a turma , sendo que todos os alunos deverão participar efetivamente da sua elaboração. Poderão ser inseridos materiais diversos, tais como: textos, imagens, vídeos, links referente ao experimento realizado.
Link: https://www.blogger.com/start
Laboratório de Química
Professor novamente separe a sala em cinco grupos iguais para que possa ser realizado um novo procedimento prático no laboratório de química:
Objetivo do experimento:
Investigar a relação entre a estrutura das moléculas e suas propriedades físicas, como a volatilidade. Desenvolver uma explicação para estas observações em termos das forças intermoleculares presentes.
Procedimento:
- Equipamentos especiais: lâminas de microscópio.
Substâncias investigadas:
- água destilada e deionizada, n-pentano, n-dodecano e etanol.
Segurança no Laboratório:
- Use luvas de latex e óculos de proteção durante todo o experimento
- Os compostos etanol, n-pentano são inflamáveis e não devem ser manipulados próximo a uma chama.
Realizando o experimento prático da volatilidade relativa:
- Coloque gotas, separadamente, das amostras líquidas abaixo em superfícies de vidro (lâminas de microscópio ou vidros de relógio) limpas e idênticas. Aguarde e acompanhe atentamente a evolução de cada uma das lâminas. Amostras: água, n-pentano, n-dodecano e etanol
Faça as seguintes anotações durante a aula prática no laboratório:
a) Quais amostras evaporam mais rapidamente?
b) Quais amostras evaporam mais lentamente?
c) Que fator estrutural está ligado à maior ou menor volatilidade (ou, em outras palavras, maior ou menor pressão de vapor)?
d) Que tipo de força intermolecular está presente nestas moléculas?
e) Justifique claramente a ordem de volatilidade encontrada.
Fonte: http://www.qmc.ufsc.br/qmcweb/artigos/sala_de_aula/forcas_intermoleculares/ acessado 03/06/2010
Logo após os alunos terem anotado todos os procedimentos e as devidas respostas das perguntas (a,b,c e d) referente a aula prática proposta acima, solicite aos alunos que se organizem em equipes de no máximo 6 pessoas e elaborem uma apresentação sobre todos os procedimentos da aula prática. Como subsídio faça a pesquisa em diversas págians da web utilizando as ferramentas do laboratório de informática. Em seguida utilizem o Software de Apresentação disponível no Google Docs para representar os resultados.
Para saber nais sobre o Google Docs acesse o tutorial que está disponível no link: http://docs.google.com/View?id=dcdf798z_163c6gmxdm
Os estudantes deverão pesquisar na web quatro substâncias que sofrem o processo de ionização e volatilização, e explicar o significado e as características de cada uma das substâncias. Proponha aos estudantes que elaborem um cartaz colorido e disponibilizem em um espaço da escola, para que os demais alunos de outras séries possam ter acesso a esse material de pesquisa.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Equilíbrio Químico da amônia: Efeito do Íon comum: Parte 1: experimento prático | Experimento prático |
| Química básica | Software Educacional |
Recursos Complementares
Brasil Escola
Fonte: http://www.brasilescola.com/quimica/grau-ionizacao-acidos.htm acessado 03/06/2010
Feira de Ciências
Fonte: http://www.feiradeciencias.com.br/sala11/11_28.asp acessado 03/06/2010
Avaliação
A avaliação deverá ser diagnóstica e formativa, ocorrer ao longo do desenvolvimento das atividades. O professor deverá informar com antecedência a turma os critérios pelos quais serão avaliados.
O professor poderá avaliar os alunos a partir dos seguintes critérios:
1. Fazer questionamentos aos colegas de sala de aula de maneira efetiva, colaborando com a aprendizagem de todos;
2. Comprometimento com o grupo na participação das atividades de laboratório;
3. Compreensão dos conceitos propostos no laboratório;
4. Participação no desenvolvimento do blog e no google docs;
5. Participação efetiva na produção de cartaz;
7. Organização no manuseio dos recursos tecnológicos disponíveis na rede e materiais a serem utilizados nas pesquisas.
8. Postura crítica ao discutir diferenças básicas entre a ionização e a volatilidade;
9. Utilizou corretamente o usa da linguagem escrita verbal/gramatical.
Sem estrelas 0 calificaciones
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncia opiniones o materiales indebidos!
- Sugerencias de clases
- Clases
- Colecciones de clases
- Crear clase
- Crear individual
- Crear em equipo
- Accede tus equipos
- Mis clases
- Orientaciones
- Creando equipos
- Pistas para producción de clases
- Reflexiones pedagógicas
- Utilizando la herramienta
- Artículo: portal educacional
- Estadísticas de uso del Portal
- Clases Estadísticas
- Estadísticas de recursos
- Estadísticas de visitas
- Recursos utilizados en las clases de
- Reflexiones pedagógicas
- Informaciones de cursos
- Cursos
- e-Proinfo
- Materiales de curso
- Materiales de estudio
- Artículos y Publicaciones
- Asuntos relevantes
- Opiniones
- Ciencias de la vida cotidiana
- Destaca Internacional
- Consejos prácticos
- La educación profesional y tecnológica
- Entrevistas
- Estrategias pedagógicas
- Las innovaciones tecnológicas
- Los materiales del curso
- Acontecimiento Materiales
- Directrices y directivas
- Parámetros y referencias
- Programas en los vídeos
- Tutoriales
- TVescola
- Cuadernos didáticos
- Colecciones de recursos
- Recursos educacionales
- Sitios temáticos
- Tv escuela en vivo
- Herramienta del portal
- Foro
- Portal em Youtube
- Compartiendo presentaciones
- Herramientas por internet
- Blog
- Compartir videos
- La comunicación en línea
- Crear y compartir presentaciones
- Editar y compartir fotos
- Escritura colaborativa
- Únete a una comunicade
- Hilo
- Organizar y compartir tus favoritos
- Podcast
- Radio / TV y otra universidad
- Redes Sociales
- Robot Ed
PLATAFORMA FREIRE
- Bibliotecas
- Proinfo integrado de capacidad
- cultura
- Diccionarios, traductores y enciclopedias
- La educación inclusiva
- Geoprocessamentos
- La inclusión digital
- Infografía
- Juegos educativos
- Periódicos
- Museos
- Observatorios y planetarios
- Organizaciones gubernamentales
- Las plataformas educativas
- Portales educativos y otros
- MEC Portal
- Profesores Premio de Brasil
- Producciones de los docentes
- Proyectos de Escuelas
- Proyectos innovadores
- Los proyectos sociales y educativos
- Escuela de Radio
- Recursos digitales
- Revistas
- Búsqueda Sitios
- Sitios portal temático y TVescola
- Software de edición y otros
- Software educativo
- Un ordenador por alumno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus



 Química básica
Química básica