07/12/2012
Edson Luis Nunes, Daniel Rodrigues Ventura, José Ângelo de Faria
| Modalidad / Nivel de Enseñanza | Disciplina | Tema |
|---|---|---|
| Ensino Fundamental Final | Ciências Naturais | Tecnologia e sociedade |
| Ensino Médio | Física | Calor, ambiente e usos de energia |
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
O que o aluno poderá aprender com esta aula
- Sobre a tendência das substâncias em receber ou doar elétrons, formando íons e culminando na criação de corrente e outros fenômenos elétricos.
- O princípio de funcionamento de uma pilha.
- Como construir uma pilha com materiais comuns do dia-a-dia.
- Como associar pilhas em série e em paralelo.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
- Cargas elétricas e corrente elétrica.
- Oxidação e redução.
- Meio ácido e meio básico.
- Diferença de potencial elétrico.
- Saber usar um multímetro para medir diferença de potencial elétrico.
Estratégias e recursos da aula
As atividades a seguir têm por objetivo mostrar como se constrói pilhas utilizando materiais simples, como realizar associações de pilhas em série e em paralelo e o que ocorre com as diferenças de potencial (ddp) nessas associações. Por meio dos experimentos propostos, verificaremos a tendência das substâncias em receber ou doar elétrons, formando íons e culminando na criação de corrente e outros fenômenos elétricos. O professor dividirá a turma em grupos de, no máximo, 5 estudantes. As atividades serão realizadas num laboratório de Física e, além dos materiais, serão utilizados recursos multimídia (computador conectado à internet e projetor multimídia) para a apresentação de pequenos vídeos e exposição de alguns conceitos.
O professor pode iniciar a atividade explicando que dois metais diferentes, quando colocados num meio líquido condutor de cargas elétricas formam uma pilha. Esse meio líquido por onde as cargas (íons, nesse caso) serão transportadas é chamado de ponte salina e não precisa ser, necessariamente, ácido (caso do limão ou do refrigerante coca-cola), mas pode ser também básico (caso da batata). Para metais diferentes colocados nesse meio condutor, surgem cargas de polaridades opostas e fica estabelecida uma diferença de potencial elétrico (ddp) entre eles. Dependendo da escolha dos pares de metais, pode-se conseguir tensões de mais de 1 V. Os pares podem ser, por exemplo, ferro/cobre, alumínio/cobre, zinco/cobre, alumínio/ferro e outros. Montada a pilha, se conectarmos os metais (nesse caso, chamados de eletrodos) por um fio condutor, teremos uma corrente de elétrons passando pelo fio.
Atividade 1. Pilha de limão
Material
– 1 limão.
– 1 placa de cobre.
– 1 placa de zinco.
– 1 voltímetro.
– Fios para conexão com garras jacarés nas pontas.
Observação: O material acima é suficiente para a realização do experimento por um grupo de estudantes.
Procedimento
Para se construir uma pilha de limão é necessário que dois eletrodos sejam espetados em um limão, sem que um toque o outro. Nesse experimento, usaremos como eletrodos uma placa de cobre e uma de zinco e o limão como solução condutora, como pode ser observado na Figura 1. Com o zinco e o cobre ligados ao mesmo meio ácido, o limão atuará como ponte salina, permitindo a corrente de íons de uma placa para a outra.
Utilizando um fio elétrico com crocodilos nas extremidades, una o fio do polo vermelho do voltímetro ao eletrodo de cobre. Com outro fio, una o polo preto do voltímetro ao eletrodo de zinco. Os fios elétricos servirão de condutores, permitindo a passagem de uma corrente de elétrons. É possível verificar que o voltímetro indica a diferença de potencial de cerca de 0,8 V (esta fonte de energia elétrica pode ser usada para alimentar um relógio digital).
Figura 1. Montagem da pilha de limão
(Figura disponível em: http://cienciaemcasa.cienciaviva.pt/pilha_limao.html)

Figura 2. Pilha de limão conectada ao multímetro
(Figura disponível em: http://cienciaemcasa.cienciaviva.pt/pilha_limao.html)
Para orientar a montagem da pilha, o professor exibirá o vídeo disponível no endereço: http://www.youtube.com/watch?v=mGfi72fp1tg
A pilha de limão segue os mesmos princípios da Pilha de Daniel, que também é composta por dois eletrodos: um de zinco (Zn) em solução de ZnSO4 e outro de cobre (Cu) em solução de CuSO4.
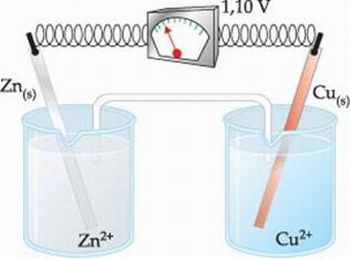
Figura 3. Pilha de Daniel
(Figura disponível em: http://www.sofi.com.br/node/773)
No eletrodo de Zn ocorre a seguinte reação:
Zn(s) ---> Zn2+(aq) + 2e (reação de oxidação)
(placa) (solução) (vão para o
eletrodo de Cu)
No eletrodo de Cu ocorre a seguinte reação:
Cu2+(aq) + 2e ---> Cu(s) (reação de redução)
(solução) (vieram do Zn (placa)
através do condutor)
Reação Global:
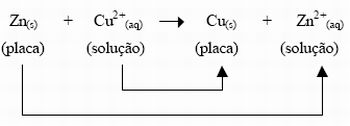
Figura 4. Reação global da Pilha de Daniel
(Figura disponível em: http://www.sofi.com.br/node/773)
Pela reação global, percebe-se que a placa de Zn sofre corrosão e ainda ocorre um aumento da concentração de Zn2+ na solução. No eletrodo de cobre, íons Cu2+ recebem os elétrons cedidos pelo Zn e se transformam em Cu, que é depositado na placa de Cu, diminuindo a concentração de Cu2+ na solução.
Para manter o equilíbrio elétrico de cargas positivas e negativas na solução, íons Zn2+ migram para o eletrodo de Cu e íons Cu2+ migram para o eletrodo de Zn, através da ponte salina.
Obs: O eletrodo que sofre redução é chamado de cátodo (polo positivo) e o eletrodo que sofre oxidação é chamado de ânodo (polo negativo).
A capacidade de atrair elétrons que cada íon metálico em solução apresenta é chamada de potencial de redução (Ered).
O Ered do cátodo é sempre maior que o Ered do ânodo, assim, o sentido da corrente elétrica que passa pelo condutor é do ânodo para o cátodo.
Representação de uma pilha: metal que sofre oxidação / íon metálico formado // íon metálico que sofre redução / metal formado
A representação da Pilha de Daniel é dada por: Zn(s) / Zn2+(aq) / / Cu2+(aq) / Cu(s)
Ao final dessa atividade, os estudantes deverão responder às seguintes perguntas:
1.Qual a diferença de potencial entre os terminais da pilha de limão?
Resposta esperada: aproximadamente 1V, conforme medição do multímetro.
2. Qual dos polos da pilha de limão é o oxidante e qual é o redutor?
Resposta esperada: O polo oxidante é o de cobre e o redutor é o de zinco.
Atividade 2. Pilhas de Coca-cola associadas em série
Material
– 2 garrafas pet (600ml);
– 2 placas de zinco (10cmx2cm);
– 2 placas de cobre (10cmx2cm);
– Fios para conexão com garras jacarés nas pontas;
– 2 rolhas de cortiça para separar as placas;
– elásticos;
– 1 led;
– 1 calculadora ou relógio que utilize uma pila AA;
– multímetro.
Observação: O material acima é suficiente para a realização do experimento por um grupo de estudantes.
Procedimento
Passo 1: Cortar as garrafas na altura de 10 cm do fundo, aproximadamente. A parte de baixo será utilizada para fazer copos.

Figura 5. Garrafas cortadas
(Figura disponível em: http://www.quimicalizando.com/experiencias/pilha-de-refrigerante)
Passo 2: Utilizando um elástico, una as placas metálicas de zinco e cobre com uma rolha entre as mesmas, evitando seu contato. Outros materiais isolantes também podem ser usados como separador das placas.

Figura 6. Conjunto de 1 placa de zinco e 1 placa de cobre separadas por 1 rolha de cortiça.
(Figura disponível em: http://www.quimicalizando.com/experiencias/pilha-de-refrigerante)
Passo 3: Após montar as placas com o separador, coloque-os dentro da garrafa cortada e acrescente cerca de 170ml da solução ácida (Coca-Cola).

Figura 7. Conjunto de placas dentro da solução ácida (Coca-cola)
(Figura disponível em: http://www.quimicalizando.com/experiencias/pilha-de-refrigerante)
Passo 4: Conecte as pilhas em série, ligando a placa de zinco de uma das pilhas à placa de cobre da outra, conforme a foto abaixo:

Figura 8. Pilhas ligadas em série.
(Figura disponível em:http://www.quimicalizando.com/experiencias/pilha-de-refrigerante)
Passo 5: Teste a passagem da corrente elétrica utilizando um multímetro. Será medida uma diferença de potencial superior a 1,6V. Esta fonte de energia elétrica pode ser usada para alimentar uma calculadora ou relógio que utilize uma pilha AA ou ainda para acender um led.
Para orientar a montagem do experimento, o professor pode exibir o vídeo disponível no endereço: http://www.youtube.com/watch?v=GaZFl9OoKLs
Em seguida o professor explicará que a diferença de potencial medida pelo multímetro é decorrente de uma reação química na qual um dos reagentes é oxidado e outro reduzido. Este processo ocorre em eletrodos diferentes, o que faz com que os elétrons passem de um polo para outro da pilha, gerando uma corrente elétrica, o que faz funcionar os dispositivos conectados. Neste caso, o polo de zinco é o negativo e a placa de cobre é o polo positivo, que só atua como um condutor elétrico e não sofre transformação.
Ao final dessa atividade, os estudantes deverão responder às seguintes perguntas:
1. A diferença de potencial das pilhas associadas em série é maior ou menor que a de uma pilha individual?
Resposta esperada: é maior, pois as diferenças de potencial das duas pilhas são somadas.
2. Explique como é feita a associação em série.
Resposta esperada: A associação em série é feita pela ligação da placa de zinco de uma das pilhas à placa de cobre da outra.
Atividade 3. Pilhas de batata associadas em paralelo
Material
• Uma batata cortada ao meio.
• Duas placas de cobre, com dimensões de 2 cm x 4 cm.
• Duas placas de zinco do mesmo tamanho que as de cobre.
• Quatro pequenos pedaços de fio de cobre 22 com garras jacaré nas pontas.
• Um multímetro.
Observação: O material acima é suficiente para a realização do experimento por um grupo de estudantes.
O professor, no início da atividade, deve dizer aos estudantes que em quase todos os aparelhos que usam pilhas, não se usa somente uma célula por vez. Elas geralmente são agrupadas de forma serial, para disponibilizar diferenças de potencial (ddps) mais altas, ou em paralelo, para suprir demandas por correntes mais altas (alimentar aparelhos de maior potência, ou seja, maior consumo de energia). Em um arranjo serial, as ddps se somam. Em um arranjo em paralelo, a ddp permanece a mesma de uma pilha individual, mas o arranjo de pilhas pode suprir uma corrente mais alta e por um tempo longo (comparado com o que pode fornecer uma pilha individual). Na figura 9 temos diagramas que mostram estes 2 arranjos:
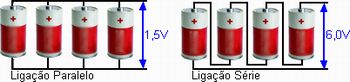
Figura 9. Esquema de associação de pilhas em paralelo e em série.
(Figura disponível em: http://www.electronica-pt.com/imagens/baterias-serie-paralelo.gif)
A seguir, o professor proporá aos estudantes a construção de duas pilhas utilizando o material disponibilizado (dessa vez, usando o corpo da batata como ponte salina) e a associação dessas pilhas em paralelo.
Procedimento
Divida uma batata ao meio e espete firmemente, em cada metade, uma placa de zinco e uma de cobre, deixando-as próximas uma da outra. Pegue quatro pequenos pedaços de fio de cobre 22 (com garras jacaré nas pontas) e prenda cada pedaço a uma das placas. Cada conjunto formado corresponde a uma pilha que oferece uma diferença de potencial (ddp) de 0,7 V entre as placas.
Associe os conjuntos em paralelo. Isso significa ligar o polo positivo de uma pilha ao polo positivo da outra e, em seguida, ligar o polo negativo de uma pilha ao polo negativo da outra, conforme representação na Figura 10.
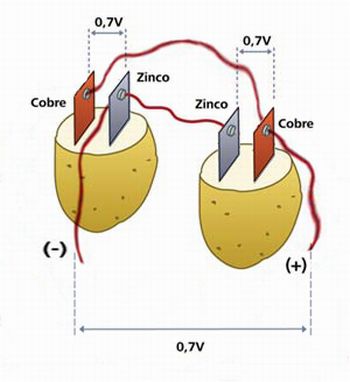
Figura 10. Pilhas de batata associadas em paralelo.
(Figura adaptada da imagem disponível no endereço http://revistaescola.abril.com.br/ensino-medio/mundo-movido-ions-530207.shtml)
Cada pilha produz ddp de 0,7V. As 2 pilhas associadas em paralelo formarão um conjunto que também produzirá 0,7V, mas esse mesmo conjunto pode, dependendo da demanda, disponibilizar uma corrente mais alta por um tempo mais longo, em comparação com o que pode fornecer, individualmente, cada pilha.
O professor deve pedir aos estudantes que utilizem um multímetro para observar a medição da diferença de potencial de 0,7V. Ele deve ainda pedir aos estudantes que, em cada grupo, discutam e proponham, para toda a sala, uma maneira de verificar a hipótese de que o conjunto de pilhas associadas em paralelo disponibiliza uma corrente maior e que dura mais tempo.
Ao final dessa atividade, os estudantes deverão responder às seguintes perguntas:
1. Ao realizarmos a medida de diferença de potencial da pilha ligando seus polos ao multímetro, obtivemos um determinado valor. O que aconteceria se a ligação dos polos ao multímetro fosse invertida?
Resposta esperada: Observaríamos um valor de mesmo módulo, mas de sinal contrário.
2. Como é feita a associação em paralelo das pilhas de batata?
Resposta esperada: A associação em paralelo é feita pela ligação das placas de zinco e de cobre de uma das pilhas às respectivas placas de zinco e de cobre da outra.
Há outros conteúdos disponíveis no Portal que poderão enriquecer ainda mais esta aula:
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Pilhas eletroquímicas | Experimento prático |
| Pilha | Áudio |
| Conversa Periódica - Pilhas e Baterias - Reações Espontâneas de Oxirredução | Vídeo |
| A química nossa de cada dia : Pilhas no cotidiano | Vídeo |
| Pilha de Daniell | Experimento prático |
| A física e o cotidiano - Experimentos Educacionais : Associação de pilhas | Experimento prático |
| Tudo se Transforma - Pilhas e Baterias | Vídeo |
Recursos Complementares
Para construção de pilhas com outros materiais, veja o seguinte endereço:
http://www.youtube.com/watch?v=vW_y5uisccE&feature=related
Para construção de pilhas com eletrodos de cobre e magnésio (performance muito boa), utilizando materiais de baixo custo, consulte o material disponível em:
Avaliação
Após a realização dessa aula sobre pilhas, o estudante deverá ser capaz de:
- Compreender o princípio de funcionamento de uma pilha.
- Entender que as substâncias tendem a receber ou doar elétrons devido a reações químicas de oxidação e redução, formando íons e culminando na criação de corrente e outros fenômenos elétricos.
- Construir uma pilha com materiais comuns do dia-a-dia.
- Medir a diferença de potencial elétrico de uma pilha usando um multímetro.
- Saber o que é uma associação de pilhas em série e em paralelo.
Quatro estrelas 17 calificaciones
- Cinco estrelas 15/17 - 88,24%
- Quatro estrelas 1/17 - 5,88%
- Três estrelas 1/17 - 5,88%
- Duas estrelas 0/17 - 0%
- Uma estrela 0/17 - 0%
Denuncia opiniones o materiales indebidos!
Opiniones
-
Alex, E. E. José Carlos Dias , São Paulo - dijo:
mail@mail.com17/01/2015
Cinco estrelasObrigado, tinha algumas dúvidas e foram completamente sanadas ;) Simples e rápido com ótimas informações. Vim só pegar uma coisinha e levei muito mais! Alex
-
raimundo nonato de pontes junior, Escola Estadual José Luiz Rodrigues , Rio Grande do Norte - dijo:
juniornonato04@hotmail.com04/11/2014
Cinco estrelasAjudou bastante
-
kb, Canadá - dijo:
Kb@gmail.com12/07/2014
Cinco estrelasGreat!!
-
Syton, Barbados - dijo:
alexxandymelosilva@hotmail.com26/03/2014
Cinco estrelasOtimo
-
Janaina Araújo, Escola Estadual Nossa Senhora de Fátima - Sanharó - PE. , Pernambuco - dijo:
maravilha_jana@hotmail.com26/01/2014
Cinco estrelasA aula está muito dinâmica e bem planejada.
-
Luciano, Colégio Energia , Santa Catarina - dijo:
lucianoqmc@ibest.com.br05/11/2013
Quatro estrelasApenas um reparo: Os experimentos mostram cobre e zinco como eletrodos. Ok, mas as explicações dão a entender que o cobre é oxidante, o que sugere que o cobre sofre redução. Isso ocorre na pilha de Daniel, mas não nos experimentos. Para que o cobre reduza, é necessário que haja íons Cu2+ na solução, o que não existe nem no limão nem na coca-cola. Nestes casos, quem sofre redução são os íons H+ do meio ácido.
-
patryanny, Universidade do Estado do Amazonas (UEA) , Amazonas - dijo:
pat_lup@hotmail.com13/03/2013
Cinco estrelasAdorei a aula, tudo muito bem explicado e facil de ser compreendido mesmo sem o auxilio de um professor. Realmente os autores de tal, estao todos de parabens.
-
Luciano, Jeam , Rio de Janeiro - dijo:
luciano.com.luciano@hotmail.com14/12/2012
Cinco estrelasEssa explicação foi ótima e vai facilitar no meu trabalho, obrigado.
-
Ana Caroline , Vetor , Rio de Janeiro - dijo:
fabianadinha@hotmail.com17/11/2012
Cinco estrelasÓtima experiência.
-
pastor rodrigo rocha, sesi senai fieg , Goiás - dijo:
rrrodrigoteba9@gmail.com14/08/2012
Cinco estrelasolha achei muito legal, e para mim vai me servir muito tenho uma feira de ciências no colegio e vou apresentar essa exelente ideia,obrigado por compartilhar sua experiência.
-
Juliana, ESCOLA ESTADUAL DOM CIRILO DE PAULA FREITAS , Minas Gerais - dijo:
julove12@hotmail.com02/04/2012
Cinco estrelasMuito bom msm o site,mais é muito dificil as experiencias...
-
irani jorge boia, E. E.PROFESSOR QUARESMA , Minas Gerais - dijo:
irnijorge@hotmail.com17/03/2012
Cinco estrelasexcelente.muito bom a escolha dos seus experimentos é de grande valia e enriquecedor para as aulas de ddp.
-
Andreana Beserra Quidute, ESCOLA DE REFERENCIA EM ENSINO MEDIO JOAO BEZERRA , Pernambuco - dijo:
aquidute@yahoo.com.br03/03/2012
Cinco estrelasexcelente, dinâmico, prático e de inteira importância para compreensão da teoria.
-
Paulo Renato Carollo de Oliveira, INSTITUTO ESTADUAL DE EDUCACAO PAULO DA GAMA , Rio Grande do Sul - dijo:
profpaulocarollo@gmail.com01/03/2012
Três estrelasNo experimento 1 está sugerida uma resposta para os agentes redutores e oxidantes que estão equivocadas. No caso, teremos como agente redutor o zinco e agente oxidante o cobre, justamente o contrário do que constou como resposta esperada pelos alunos. Espero ter contribuído para que esse excelente material possa ser utilizado com correção. Excelente iniciativa! Parabéns!
-
nubia duarte da cruz, EE ULISSES GUIMARAES , Mato Grosso - dijo:
nubiaduartecruz@bol.com.br30/01/2012
Cinco estrelasÓtima aula. Obrigada por divulgar suas ideias. Como disse a colega, mesmo conhecendo algumas práticas sempre podemos acrescentar algo novo. Parabéns
-
RONALDO OLIVEIRA CEDRIM AZEVEDO, ESCOLA ESTADUAL PROFESSORA MARIA ANTONIA DE OLIVEIRA SANTOS , Alagoas - dijo:
ronaldo-cedrim@ig.com.br24/11/2011
Cinco estrelasMuito bom, se todos disponibilizassem suas ideias e recursos todas as escolas poderiam realizar experimentos. Pois são experimentos com material simples, mas de grande importância, principalmente para as unidades escolares que não tem disponível laboratório, ou seja, a granda maioria das unidades escolares de nosso país.
-
Shirley de Almeida Gavina, CE CINAMOMO , Rio de Janeiro - dijo:
shirleygavina@yahoo.com.br22/10/2011
Cinco estrelasÓtimo, pois embora já conhecesse sempre é interessante acrescentar informações.
- Sugerencias de clases
- Clases
- Colecciones de clases
- Crear clase
- Crear individual
- Crear em equipo
- Accede tus equipos
- Mis clases
- Orientaciones
- Creando equipos
- Pistas para producción de clases
- Reflexiones pedagógicas
- Utilizando la herramienta
- Artículo: portal educacional
- Estadísticas de uso del Portal
- Clases Estadísticas
- Estadísticas de recursos
- Estadísticas de visitas
- Recursos utilizados en las clases de
- Reflexiones pedagógicas
- Informaciones de cursos
- Cursos
- e-Proinfo
- Materiales de curso
- Materiales de estudio
- Artículos y Publicaciones
- Asuntos relevantes
- Opiniones
- Ciencias de la vida cotidiana
- Destaca Internacional
- Consejos prácticos
- La educación profesional y tecnológica
- Entrevistas
- Estrategias pedagógicas
- Las innovaciones tecnológicas
- Los materiales del curso
- Acontecimiento Materiales
- Directrices y directivas
- Parámetros y referencias
- Programas en los vídeos
- Tutoriales
- TVescola
- Cuadernos didáticos
- Colecciones de recursos
- Recursos educacionales
- Sitios temáticos
- Tv escuela en vivo
- Herramienta del portal
- Foro
- Portal em Youtube
- Compartiendo presentaciones
- Herramientas por internet
- Blog
- Compartir videos
- La comunicación en línea
- Crear y compartir presentaciones
- Editar y compartir fotos
- Escritura colaborativa
- Únete a una comunicade
- Hilo
- Organizar y compartir tus favoritos
- Podcast
- Radio / TV y otra universidad
- Redes Sociales
- Robot Ed
PLATAFORMA FREIRE
- Bibliotecas
- Proinfo integrado de capacidad
- cultura
- Diccionarios, traductores y enciclopedias
- La educación inclusiva
- Geoprocessamentos
- La inclusión digital
- Infografía
- Juegos educativos
- Periódicos
- Museos
- Observatorios y planetarios
- Organizaciones gubernamentales
- Las plataformas educativas
- Portales educativos y otros
- MEC Portal
- Profesores Premio de Brasil
- Producciones de los docentes
- Proyectos de Escuelas
- Proyectos innovadores
- Los proyectos sociales y educativos
- Escuela de Radio
- Recursos digitales
- Revistas
- Búsqueda Sitios
- Sitios portal temático y TVescola
- Software de edición y otros
- Software educativo
- Un ordenador por alumno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


