12/09/2011
Daniel Rodrigues Ventura, Edson Luís Nunes
| Modalidad / Nivel de Enseñanza | Disciplina | Tema |
|---|---|---|
| Educação de Jovens e Adultos - 2º ciclo | Ciências Naturais | Visões de mundo |
| Ensino Médio | Física | Calor, ambiente e usos de energia |
O que o aluno poderá aprender com esta aula
· Interpretar o conceito de capacidade térmica.
· Relacionar bem como diferenciar calor específico e capacidade térmica.
· Avaliar a aplicação térmica da utilização de materiais ou substâncias na prática em função de seu calor específico.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Conceitos de calor e temperatura, Processos de propagação de calor.
Estratégias e recursos da aula
Sugerimos que inicialmente o professor apresente para a turma o filme abaixo para despertar interesse e assim entender melhor o conteúdo da aula. O filme com o título: Novo Telecurso – Física EM – Aula 23, se encontra disponível na internet no seguinte endereço:
http://video.globo.com/Videos/Player/0,,GIM1291125-7759-NOVO+TELECURSO+FISICA+EM+AULA,00.html
Após apresentação do filme o professor então deverá comentar e discutir a parte que fala sobre aplicação do conceito da grandeza capacidade térmica ou capacidade calorífica, e definir matematicamente esta grandeza.
Capacidade térmica (C) de um corpo é uma grandeza física que define a variação de sua temperatura ao receber certa quantidade de calor (Q). Quanto mais elevada for a capacidade térmica de um corpo, maior será a quantidade de calor que ele necessita para que sua temperatura varie de uma unidade. A capacidade térmica (C) de um corpo é matematicamente representada pela expressão: C= Q/(T2 – T1), sendo Q a quantidade de calor que ele recebe ou cede e (T2 – T1), a variação de temperatura.
Atividade I.
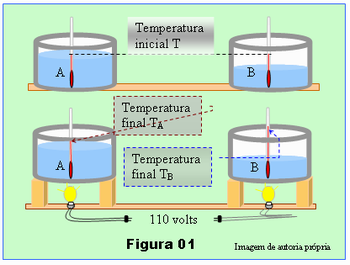
Para exemplificar a capacidade térmica ou capacidade calorífica de um sistema, o professor poderá fazer com a turma uma prática, bastante simples, esquematizada pela Figura 01. O material necessário consiste de; dois recipientes iguais, A e B, preferencialmente transparentes para permitir leitura nos termômetros, por exemplo, dois copos grandes de vidro; dois termômetros; duas lâmpadas incandescentes iguais, de 100 watts de potência; dois bocais para conectar lâmpadas; duas tomadas com plug macho; cerca de 2 metros de fio duplo e uma extensão para ser ligada na rede elétrica.
Sendo possível, distribua a turma em equipes de 4 ou 5 elementos, para que todos possam participar ativamente do experimento.
Não dispondo de material suficiente, o professor poderá executar o experimento com auxílio de alguns alunos, em um espaço que todos consigam observar todo o desenvolvimento do experimento, inclusive checando as leituras de temperatura.
Procedimento: Pegue água à temperatura ambiente, coloque 200ml dessa água em um dos recipientes e 100 ml de água no outro. Em cada recipiente introduza um termômetro, espere um pouco para o termômetro entrar em equilíbrio térmico com a água, faça as leituras da temperatura que deverão ter o mesmo valor nos dois termômetros, temperaturas T, no esquema da Figura 01. Anote o valor de T.
Em seguida, coloque os recipientes sobre suportes, dois bloquinhos de madeira, por exemplo, de modo que uma lâmpada possa ser fixada debaixo de cada recipiente sob o ponto médio desses, veja na figura. As lâmpadas, que deverão ser previamente adaptadas num bocal apropriado para lâmpadas, deverão ser conectadas numa mesma extensão para serem ligadas simultaneamente na tomada de energia elétrica. Após ligar as lâmpadas, aguarde cerca de 5 minutos, desligue as lâmpadas, misture a água para homogeneizar a temperatura e faça novamente leitura nos dois termômetros, anotando as temperaturas TA e TB, esquema na parte inferior da Figura 01.
Peça para os alunos anotarem individualmente em seus cadernos ou em uma folha de papel os valores de T, de TA e de TB. Pergunte aos alunos para responderem oralmente. Qual a provável causa da diferença entre as temperaturas TA e TB? Deixe que manifestem, faça uma pausa, e deixe para eles concluir depois.
Em seguida, o professor deverá explicar aos alunos que devido a complexidade para determinar o valor da quantidade de calor absorvida pelos sistemas com precisão razoável, considere para o momento que a quantidade de calor Q absorvido pelo copo e água seja de 1500 cal, cerca de 6300 J. Usando este valor para a quantidade de calor absorvida peça aos alunos que determine:
Com as temperaturas medidas, calcule a capacidade térmica CA do conjunto, recipiente e água, esquema A, e a capacidade térmica CB do conjunto B.
Peça também para comparar os resultados e explicar a causa da diferença entre eles.
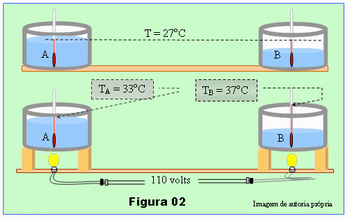
Para exemplificar a solução, suponha que uma equipe tenha encontrado os resultados como na Figura 02, abaixo; T = 27oC; TA = 33oC e TB = 37oC. Nesse caso:
- Para o sistema A
- CA = Q/ (TA – T)
- CA = 1500 cal/(33oC – 27oC)
- CA = 1500 cal/6oC
- CA= 250 cal/oC
- Para o sistema B
- CB = Q/ (TB – T)
- CB = 1500 cal/(37oC – 27oC)
- CB= 1500 cal/10oC
- CB= 150 cal/oC
Como os recipientes são iguais, aquele que contem maior quantidade de água requer maior quantidade de calor para sofrer a variação de uma unidade em sua temperatura.
Após esta explicação, pergunte a eles porque a capacidade térmica de B não é a metade do valor da capacidade de A, já que o volume de água de A é o dobro da de B?
· Se sentirem dificuldade, para responder, o professor deverá intervir para explicar que o vidro, iguais nos dois casos, também participa da troca de calor, por isso a capacidade térmica dos sistemas A e B não foram inversamente proporcionais à quantidade de água.
Atividade II
Em seguida o professor poderá realizar o seguinte procedimento para que possa ser verificado experimentalmente o calor específico de um material. Para este experimento o material a ser utilizado consiste de: um béquer ou copo cheio com água quente; outro copo com 100 ml de água à temperatura ambiente; dois termômetros e um prego grande de massa conhecida, ou de preferência, peça um voluntário da turma para medir a massa do prego, perante a observação de todos, usando uma balança.
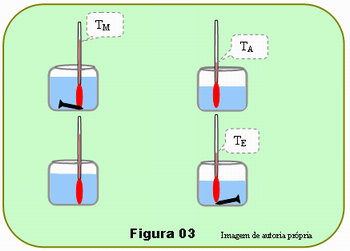
O procedimento está esquematizado na Figura 03. Encha um copo de vidro com água quente, cerca de 60oC ou mais. Coloca-se um termômetro nesse copo e mergulhe nele o prego de massa conhecida; Em outro copo despeje 100 ml de água à temperatura ambiente colocando nele outro termômetro para medir a temperatura de sua água. Após cerca de 5 minutos, para que o prego entre em equilíbrio com a água, mistura-se ligeiramente a água quente e verifica-se sua temperatura anotando seu valor, TM. Anote também a temperatura TA da água à temperatura ambiente. Retira-se o prego da água quente e mergulhe-o imediatamente no copo com 100 ml de água à temperatura ambiente.
Espera-se pelo menos 5 minutos, mistura-se a água e faz-se nova leitura, anotando o valor de TE, temperatura de equilíbrio da água com o prego.
Peça aos alunos então que façam as seguintes ponderações:
1. Considere que ao ser colocado o prego na água de temperatura ambiente, fluirá calor do prego, temperatura mais elevada, para a água, menor temperatura; portanto o prego perderá calor e a água ganhará calor.
2. A temperatura do prego então diminuirá enquanto perde calor, de TM até atingir o equilíbrio térmico com a água, ou seja, até atingir a temperatura TE.
3. Em contrapartida, a temperatura da água aumentará, enquanto ganha calor, de TA até atingir o equilíbrio térmico com o prego, temperatura TE.
4. Considere também que a quantidade de calor cedida pelo prego seja absorvida pelo sistema copo e água.
5. Considere ainda que a capacidade térmica do copo com 100 ml de água seja igual a 150 Cal/oC, conforme exercício anterior.
Peça então para os alunos que:
Usando a definição matemática de capacidade térmica, C, calcule a quantidade de calor QA, absorvida pelo sistema copo e água em função das temperaturas TA e TE?
Qual a quantidade de calor cedida pelo prego?
Qual a capacidade térmica do prego?
Divida esse valor pela massa do prego. O que significa esse resultado?
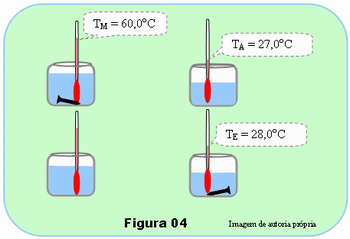
Para efeito de solução, suponha que no experimento tenha encontrado os valores cotados na Figura 04: TE = 28,0oC; TA = 27,0oC e a capacidade térmica do copo com 100 ml de água, C = 150 cal/oC, de acordo com o exercício anterior.
- C = Q/(TE – TA)
- Q = C.(TE – TA)
- Q = 150cal/oC(28,0 – 27,0)oC
- Q = 150cal(1,0)
- Q = 75 cal
Considerando calor cedido pelo prego = calor absorvido pela água
- QC = QA
- QC = 75 cal
Capacidade térmica do prego (Cp).
- Cp = QC/( TE – TM)
- Cp = 75cal/(28,0 – 60,0)oC
- Cp = -2,3 cal/oC, em que o sinal negativo se refere ao calor cedido.
- Cp = 2,3 cal/oC
Capacidade térmica do prego, dividido pela sua massa.
- Cp/m = 2,3(cal/oC)/15g
- Cp/m = 0,15 cal/g.oC
- Cp/m é a capacidade térmica dividida pela massa corresponde ao calor específico do material do prego, portanto o calor específico do material do prego é cp = 0,15 cal/goC.
O professor deverá informar que o calor específico é uma característica da substância ou material, normalmente encontrado em tabelas nos livros de Física e textos científicos.
Que da definição c = C/m, origina-se a expressão, muito comum em Física: Q = m.c.(T2 – T1), sendo Q a quantidade de calor absorvido ou cedida pelo corpo, m a massa do corpo, c é o calor específico do material constituinte do corpo e T2 – T1 é a variação de temperatura sofrida pelo corpo.
Que o objetivo do experimento é meramente didático não resultando em um valor preciso da grandeza procurada. Em um experimento prático, diversos fatores devem ser levados em consideração porque interferem no resultado; erros de leituras, sensibilidade e precisão dos instrumentos (termômetro, no exemplo), troca de calor com o ambiente, etc.
Atividade III
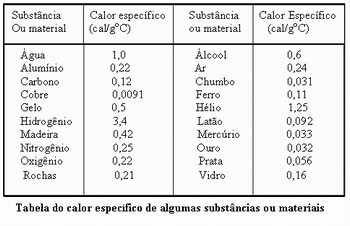
O professor poderá apresentar a tabela abaixo sobre o calor específico de algumas substâncias e materiais para que observem e façam comparação de alguns valores. Chamar a atenção especial para o calor específico de algumas substâncias como o ar e a água que apresentam alto calor específico, bem como os metais, que em geral possuem baixo calor específico.
Para testar e ao mesmo tempo assegurar maior assimilação do conteúdo da aula, o professor poderá apresentar a tabela abaixo e fazer o seguinte questionamento:
Vocês se encontram numa situação que é preciso tomar uma decisão eficaz para solucionar um problema: O objetivo é aquecer 8 litros de água que se encontram à temperatura ambiente até que essa água entre em ebulição no menor tempo possível. À disposição estão os seguintes elementos:
1. Um fogão de duas bocas, ou seja, duas chamas de gás.
2. Dois recipientes cilíndricos de mesma capacidade, mesma massa, um de cobre e outro de alumínio.
3. Quatro recipientes de mesma capacidade (até 5 litros), mesma massa, sendo dois de cobre e dois de alumínio.
A Figura 05 ilustra 4 situações, esquemas A, B, C e D, em que uma delas corresponde ao menor tempo para ferver os oito litros de água. Qual é a situação e como você justifica sua escolha?
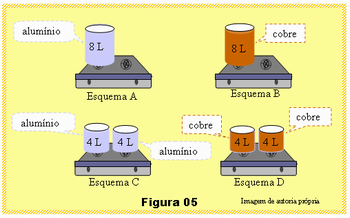
· Examinando os valores do calor específico do cobre e do alumínio na tabela deverão responder que o esquema D ferverá a água em um menor intervalo de tempo.
Justificativa:
A opção pelo esquema D se deve principalmente à duas razões:
- Como os recipientes também aquecem, para uma mesma variação de temperatura, o cobre absorverá menos quantidade de calor que o alumínio, seu calor específico é muito menor que o calor específico do alumínio, veja tabela.
- No esquema D, há duas chamas, fornece o dobro da quantidade de calor que no esquema B, para aquecer a mesma quantidade de água, ou seja, cada chama aquecerá 4 litros de água enquanto em B há apenas uma chama para aquecerá 8 litros de água.
Recursos Complementares
O texto abaixo pode ser útil para o professor, acesse o seguinte endereço:
Avaliação
Embora durante o desenvolvimento da aula o professor perceba que houve assimilação do conteúdo, se achar necessário, poderá elaborar uma tarefa para cada aluno desenvolver individualmente, em horário propício, e posteriormente discutir com todo grupo em aula. Por exemplo, peça que individualmente faça uma consulta em livros ou em outras fontes para encontrar o calor específico médio do solo a fim de explicar a formação das brisas à beira mar, em dias de céu limpo, sobretudo à tarde e de madrugada.
Sem estrelas 0 calificaciones
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncia opiniones o materiales indebidos!
- Sugerencias de clases
- Clases
- Colecciones de clases
- Crear clase
- Crear individual
- Crear em equipo
- Accede tus equipos
- Mis clases
- Orientaciones
- Creando equipos
- Pistas para producción de clases
- Reflexiones pedagógicas
- Utilizando la herramienta
- Artículo: portal educacional
- Estadísticas de uso del Portal
- Clases Estadísticas
- Estadísticas de recursos
- Estadísticas de visitas
- Recursos utilizados en las clases de
- Reflexiones pedagógicas
- Informaciones de cursos
- Cursos
- e-Proinfo
- Materiales de curso
- Materiales de estudio
- Artículos y Publicaciones
- Asuntos relevantes
- Opiniones
- Ciencias de la vida cotidiana
- Destaca Internacional
- Consejos prácticos
- La educación profesional y tecnológica
- Entrevistas
- Estrategias pedagógicas
- Las innovaciones tecnológicas
- Los materiales del curso
- Acontecimiento Materiales
- Directrices y directivas
- Parámetros y referencias
- Programas en los vídeos
- Tutoriales
- TVescola
- Cuadernos didáticos
- Colecciones de recursos
- Recursos educacionales
- Sitios temáticos
- Tv escuela en vivo
- Herramienta del portal
- Foro
- Portal em Youtube
- Compartiendo presentaciones
- Herramientas por internet
- Blog
- Compartir videos
- La comunicación en línea
- Crear y compartir presentaciones
- Editar y compartir fotos
- Escritura colaborativa
- Únete a una comunicade
- Hilo
- Organizar y compartir tus favoritos
- Podcast
- Radio / TV y otra universidad
- Redes Sociales
- Robot Ed
PLATAFORMA FREIRE
- Bibliotecas
- Proinfo integrado de capacidad
- cultura
- Diccionarios, traductores y enciclopedias
- La educación inclusiva
- Geoprocessamentos
- La inclusión digital
- Infografía
- Juegos educativos
- Periódicos
- Museos
- Observatorios y planetarios
- Organizaciones gubernamentales
- Las plataformas educativas
- Portales educativos y otros
- MEC Portal
- Profesores Premio de Brasil
- Producciones de los docentes
- Proyectos de Escuelas
- Proyectos innovadores
- Los proyectos sociales y educativos
- Escuela de Radio
- Recursos digitales
- Revistas
- Búsqueda Sitios
- Sitios portal temático y TVescola
- Software de edición y otros
- Software educativo
- Un ordenador por alumno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


