25/11/2009
Edson Luis Nunes, Daniel Rodrigues Ventura, Isnard Domingos Ferraz, José Ângelo de Faria.
| Modalidad / Nivel de Enseñanza | Disciplina | Tema |
|---|---|---|
| Ensino Médio | Física | Calor, ambiente e usos de energia |
O que o aluno poderá aprender com esta aula
Entender qual o efeito, no estado de um gás perfeito, da ocorrência de alteração no valor de uma das suas variáveis de estado.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Temperatura na escala Kelvin, pressão, volume e densidade absoluta.
Estratégias e recursos da aula
Comece fazendo ao alunos as seguintes perguntas:
1) qual a quantidade máxima de gás liquefeito de petróleo que é seguro colocar num botijão de cozinha sem que haja o perigo de rompimento da carcaça do botijão por excesso de pressão, o que poderia causar acidentes domésticos muito graves?
2) na geladeira, no ar condicionado das casas e dos carros, o que provoca o resfriamento do ar, ou seja, o que força o fluxo da energia térmica contrário ao fluxo natural (da região fria para a região quente)?
3) qual o princípio de funcionamento de uma usina nuclear? E do motor dos carros?
Após alguns momentos ouvindo as possíveis respostas, diga a eles que a aula sobre as Leis de Boyle, de Charles e de Charles/Gay-Lussac nos permitirá encontrar o início da resposta para estas perguntas. Pergunte aos alunos também, se com base nos exemplos dados, eles conseguem dar mais exemplos de outras aplicações práticas que, o estudo que será feito sobre gases, nos permitirá compreender. Filtre cada um dos exemplos dizendo se é correto ou não e explique-o. Dê a resposta para as três perguntas iniciais somente ao final da aula.
Comece fazendo ao alunos as seguintes perguntas:
1) qual a quantidade máxima de gás liquefeito de petróleo que é seguro colocar num botijão de cozinha sem que haja o perigo de rompimento da carcaça do botijão por excesso de pressão, o que poderia causar acidentes domésticos muito graves?
2) na geladeira, no ar condicionado das casas e dos carros, o que provoca o resfriamento do ar, ou seja, o que força o fluxo da energia térmica contrário ao fluxo natural (da região fria para a região quente)?
3) qual o princípio de funcionamento de uma usina nuclear? E do motor dos carros?
Após alguns momentos ouvindo as possíveis respostas, diga a eles que a aula sobre as Leis de Boyle, de Charles e de Charles/Gay-Lussac nos permitirá encontrar o início da resposta para estas perguntas. Pergunte aos alunos também, se com base nos exemplos dados, eles conseguem dar mais exemplos de outras aplicações práticas que, com estudo que será feito sobre gases, será possível compreender. Filtre cada um dos exemplos dizendo se é correto ou não e explique-o. Dê a resposta para as três perguntas iniciais somente ao final da aula.
Inicie agora o conteúdo dizendo que estudaremos os gases perfeitos porque eles tem um comportamento padrão, qualquer que seja o gás. Para um gás ser chamado de perfeito ele tem que obedecer as leis de Boyle, Charles e Charles/Gay-Lussac. Estas leis estabelecem as regras de comportamento de um gás do ponto de vista das grandezas físicas associadas ao mesmo. Estas grandezas, também chamadas de variáveis de estado do gás, são: temperatura (na escala Kelvin), pressão e volume.
A temperatura é uma grandeza física que nos dá uma medida da energia cinética de translação das partículas do gás. O volume é uma grandeza física que depende do recipiente onde o gás se encontr a (c apacidade do recipiente que o contém). A grandeza pressão, provocada por este gás, é devido ao choque das partículas desse gás com as paredes do recipiente onde ele se encontra.
Para determinada massa constante de gás, a variação de uma destas grandezas vai ser chamada de transformação sofrida pelo gás.
Diga aos alunos agora que a primeira transformação que vamos estudar é a isotérmica (à temperatura constante), também chamada de Lei de Boyle. Pergunte a eles o que acham que acontece com a pressão de um gás contido em um recipiente de volume variável (um pistão dotado de um êmbolo, por exemplo) quando se diminui o volume do recipiente á temperatura constante. Quando um aluno der a resposta correta apresente a Figura 1 e explique o que acontece com a pressão quando se aumenta ou diminui o volume do recipiente de uma massa constante de gás perfeito. Depois, apresente a Figura 2 e mostre que o mesmo pode acontecer com outros valores de temperatura, desde que constante.
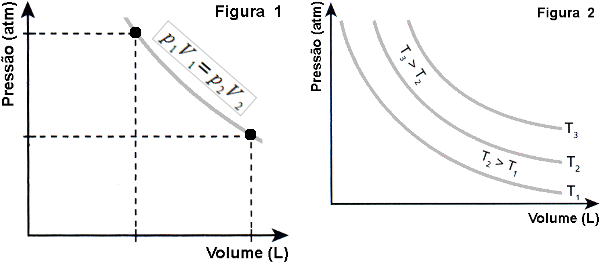
(imagem de autoria pessoal)
Pergunte a eles agora o que acham que acontece com a pressão de um gás contido em um recipiente de volume constante (um pistão dotado de um êmbolo fixado em uma posição) quando se aumenta a temperatura do gás do recipiente a volume constante. Quando um aluno der a resposta correta apresente a Figura 3 e explique o que acontece com a pressão quando se aumenta ou diminui a temperatura de uma massa constante de gás perfeito. Depois, apresente a Figura 4 e mostre que o mesmo pode acontecer com outros valores de volume, desde que constante. Diga que esta transformação é chamada de isovolumétrica ou isométrica, ou Lei de Charles.
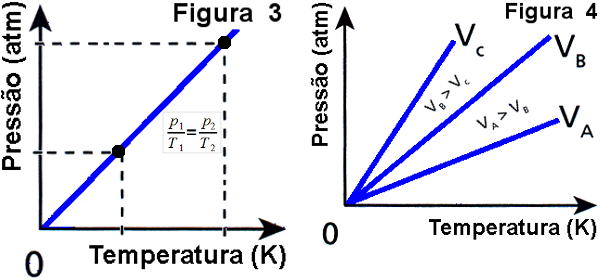
(imagem de autoria pessoal)
Por fim, pergunte então o que acham que acontece com volume de um gás contido em um recipiente de volume variável quando se aumenta a temperatura do gás no recipiente à pressão constante. Quando um aluno der a resposta correta apresente a Figura 5 e explique o que acontece com o volume quando se aumenta ou diminui a temperatura de uma massa constante de gás perfeito. Depois, apresente a Figura 6 e mostre que o mesmo pode acontecer com outros valores de pressão, desde que constante. Diga que esta transformação é chamada de isobárica, ou Lei de Charles/Gay-Lussac.
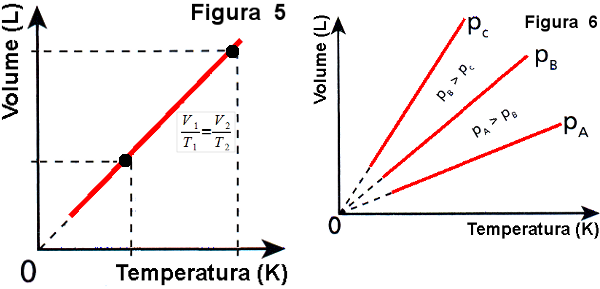
(imagem de autoria pessoal)
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Transformações gasosas | Animação/simulação |
| Dilatação volumétrica do ar | Experimento prático |
Recursos Complementares
Aprenda mais sobre a Lei de Boyle, a Lei de Charles e a Lei de Charles/Gay-Lussac:
UOL Educação: http://educacao.uol.com.br/fisica/ult1700u14.jhtm
Física.Net: http://www.fisica.net/quimica/resumo17.htm
NEWTON, V.B; HELOU, R.D.; GUALTER, J.B. Tópicos de Física 2 – Termologia, Ondulatória e Óptica. São Paulo: Editora Saraiva, Vol. 2, 448p., 18a Ed., 2007.
Avaliação
Elabore questões teóricas e práticas sobre esse assunto. Explore muito a análise dos gráficos de cada uma das transformações nas questões teóricas. Nas questões práticas explore a relação entre duas variáveis de um estado inicial e uma das duas variáveis do estado final que não foi dada no enunciado da questão.
Sem estrelas 0 calificaciones
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncia opiniones o materiales indebidos!
- Sugerencias de clases
- Clases
- Colecciones de clases
- Crear clase
- Crear individual
- Crear em equipo
- Accede tus equipos
- Mis clases
- Orientaciones
- Creando equipos
- Pistas para producción de clases
- Reflexiones pedagógicas
- Utilizando la herramienta
- Artículo: portal educacional
- Estadísticas de uso del Portal
- Clases Estadísticas
- Estadísticas de recursos
- Estadísticas de visitas
- Recursos utilizados en las clases de
- Reflexiones pedagógicas
- Informaciones de cursos
- Cursos
- e-Proinfo
- Materiales de curso
- Materiales de estudio
- Artículos y Publicaciones
- Asuntos relevantes
- Opiniones
- Ciencias de la vida cotidiana
- Destaca Internacional
- Consejos prácticos
- La educación profesional y tecnológica
- Entrevistas
- Estrategias pedagógicas
- Las innovaciones tecnológicas
- Los materiales del curso
- Acontecimiento Materiales
- Directrices y directivas
- Parámetros y referencias
- Programas en los vídeos
- Tutoriales
- TVescola
- Cuadernos didáticos
- Colecciones de recursos
- Recursos educacionales
- Sitios temáticos
- Tv escuela en vivo
- Herramienta del portal
- Foro
- Portal em Youtube
- Compartiendo presentaciones
- Herramientas por internet
- Blog
- Compartir videos
- La comunicación en línea
- Crear y compartir presentaciones
- Editar y compartir fotos
- Escritura colaborativa
- Únete a una comunicade
- Hilo
- Organizar y compartir tus favoritos
- Podcast
- Radio / TV y otra universidad
- Redes Sociales
- Robot Ed
PLATAFORMA FREIRE
- Bibliotecas
- Proinfo integrado de capacidad
- cultura
- Diccionarios, traductores y enciclopedias
- La educación inclusiva
- Geoprocessamentos
- La inclusión digital
- Infografía
- Juegos educativos
- Periódicos
- Museos
- Observatorios y planetarios
- Organizaciones gubernamentales
- Las plataformas educativas
- Portales educativos y otros
- MEC Portal
- Profesores Premio de Brasil
- Producciones de los docentes
- Proyectos de Escuelas
- Proyectos innovadores
- Los proyectos sociales y educativos
- Escuela de Radio
- Recursos digitales
- Revistas
- Búsqueda Sitios
- Sitios portal temático y TVescola
- Software de edición y otros
- Software educativo
- Un ordenador por alumno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus




