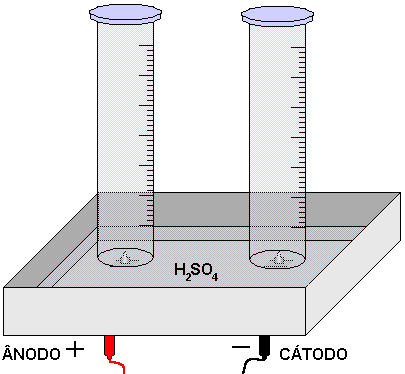
Figura 1 - Montagem do Experimento.
ELETRÓLISE
MATERIAL UTILIZADO
PROCEDIMENTO
INTRODUÇÃO:
Durante
o início do século XIX, Michael Faraday estabeleceu algumas relações
quantitativas, conhecidas como as leis de Faraday para a eletrólise. São elas:
(1) que a quantidade de substância produzida pela eletrólise é proporcional
à quantidade de eletricidade utilizada e (2) que para uma dada quantidade de
eletricidade a quantidade de substância produzida é proporcional à sua massa
equivalente.
Para
uma ilustração da primeira lei de Faraday, consideremos a eletrólise do NaCl
fundido. No cátodo se dá a reação
Na+
+ e- ®
Na(l)
A
equação acima expressa a primeira lei de Faraday, pois mostra que um elétron
é necessário para produzir um átomo de sódio. Isto significa que um mol de
elétrons será necessário para produzir um mol de átomos de sódio.
A
mesma eletrólise do NaCl fundido ilustra a segunda lei de Faraday. No ânodo a
reação é
2Cl-
® Cl 2 + 2e-
Aqui, dois
elétrons devem ser retirados (de dois íons Cl-) para a produção
de uma molécula de Cl2. Assim, dois moles de elétrons são necessários
para produzi um mol de moléculas de Cl2. Isto significa que um
equivalente de Cl2 (a quantidade produzida por um mol de elétrons)
é 0,5 mol (a massa equivalente é a metade da massa molecular). Quando o NaCl
fundido for eletrolisado, um Faraday de eletricidade produzirá um equivalente
(1 mol) de Na no cátodo mais um equivalente (0,5 mol) de Cl2 no ânodo
(consomem-se duas vezes mais elétrons para produzir 1 mol de Cl2 do
que para produzir 1 mol de Na).
-
Cuba
eletrolítica.
-
Fonte de corrente contínua.
-
1000
mL de solução de ácido sulfúrico (H2SO4) 5%.
-
1000
mL de solução de ácido clorídrico (HCl) 10%.
-
1000
mL de solução de cloreto de sódio (NaCl) 10%
1 - Preparar 1000 mL de soluções 5 % m/v de ácido sulfúrico 10%, ácido clorídrico e cloreto de sódio 10%. Identificar as soluções.
2 - Colocar a solução de ácido sulfúrico numa cuba eletrolítica, invertendo uma proveta no cátodo(-) e outra no ânodo(+), preenchendo-as com a mesma solução. Observe a montagem do experimento na FIGURA 1. Use luvas e óculos de proteção.

Figura 1 - Montagem do Experimento.
3 - Conectar os pólos (+) fio vermelho da fonte no ânodo e (-) fio preto no cátodo.
4 - Ajustar a fonte alimentadora em aproximadamente 10V e disparar o cronômetro, assim que começar a eletrólise, anotar o valor de corrente medida a cada minuto. Parar o cronômetro quando estiver coletado aproximadamente 60,0 mL de hidrogênio. Anotar todas as observações. A FIGURA 2 mostra como será o andamento do experimento para a solução de H2SO4.
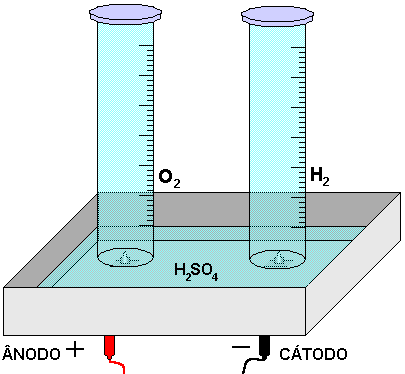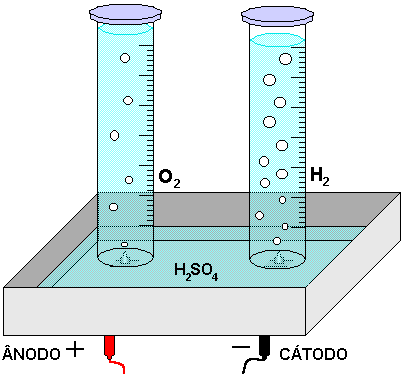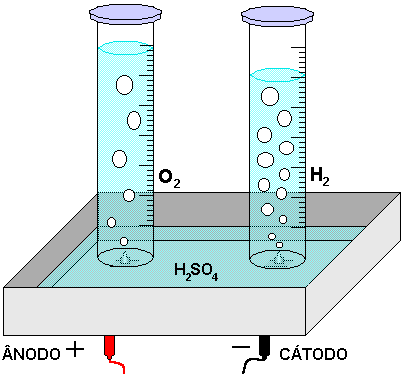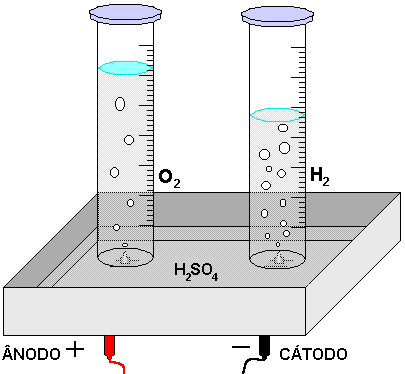
Figura 2 - Eletrólise do H2SO4.
5 - Provar a formação dos gases hidrogênio e oxigênio, fazendo uma explosão e fazendo arder uma brasa de madeira (palito de fósforo) na atmosfera de gás, respectivamente.
6
- Lavar todo material e
repetir o procedimento para as outras duas soluções. Consultar o capítulo 18,
Volume 2 do livro Química Geral do Russel e ver as reações de cátodo e de ânodo
e como poderia ser provado a formação dos produtos.
![]() CUIDADO
IMPORTANTE: Jamais inverta os pólos depois de ter eletrolisado as substâncias.
Há risco de acidente grave principalmente no caso da eletrólise do ácido
sulfúrico. 2H2 + O2 à
H2O é uma reação muito explosiva.
CUIDADO
IMPORTANTE: Jamais inverta os pólos depois de ter eletrolisado as substâncias.
Há risco de acidente grave principalmente no caso da eletrólise do ácido
sulfúrico. 2H2 + O2 à
H2O é uma reação muito explosiva.
PROCEDIMENTO:
1 -) Escrever as equações de ionização do H2SO4 e HCl e dissociação do NaCl.
2 -) Escrever as equações de oxidação e redução para o ânodo e o cátodo respectivamente.
3 -) Considere a eletrólise de uma mesma solução num mesmo tempo t. Primeiro, aplica-se 10 V e depois repete-se aplicando 20 V. O que ocorre em ambas as condições? Explique detalhadamente.