24/11/2008
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
O que o aluno poderá aprender com esta aula
• Conceituar o produto iônico da água (Kw);
• Relacionar o valor do produto iônico da água com a temperatura.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
• Equilíbrio Químico;
• Constante de ionização;
• Relações de proporcionalidade.
Estratégias e recursos da aula
Conteúdos específicos:
- Equilíbrio iônico da água;
- Produto iônico da água;
- Relação entre o produto iônico da água e a temperatura.
Recurso educacional:
• Constante de Equilíbrio:
Introduzindo a aula: (5 min.)
Inicie a aula explicando aos alunos que as moléculas dos ácidos e das bases em contato com a água sofrem ionização. Após essa explicação, pergunte aos alunos se é possível a água sofrer ionização?
Desenvolvendo a aula: (25 min.)
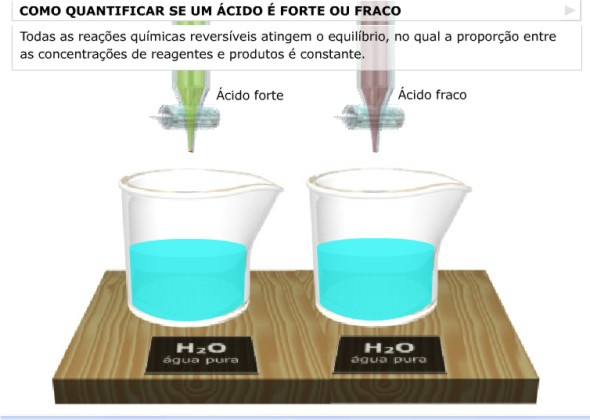
Em seguida, divida a turma em grupos de três ou quatro alunos. Solicite que cada grupo inicie a simulação: Constante de Equilíbrio presente no Portal do Professor: http://portaldoprofessor.mec.gov.br/storage/recursos/10175/constante_equilibrio.swf.

Explique aos alunos que eles deverão clicar nas setas para prosseguir nas explicações. Após o término da simulação, explique aos alunos que a simulação mostra como ocorre a ionização de um ácido forte e de um ácido fraco, pergunte aos alunos se eles conseguem escrever a equação do equilíbrio iônico da água? Após ouvir as respostas dos alunos e de deixar que alguns alunos escrevam a equação do equilíbrio iônico da água, explique aos alunos que de uma forma geral podemos representar simbolicamente a equação de ionização de um ácido da seguinte maneira:
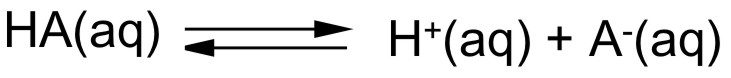
Em seguida explique aos alunos que medidas experimentais de condutividade elétrica e outras evidências mostram que a água, quando pura ou quando usada como solvente, se ioniza numa extensão muito pequena, originando o equilíbrio:

ou simplificadamente:

Após as explicações, pergunte aos alunos se as concentrações dos íons H+ e OH- são iguais? Após ouvir as indagações dos alunos, explique que as concentrações de íons H+ e OH- presentes no equilíbrio variam com a temperatura mas serão sempre iguais entre si:
Água pura [H+] = [OH-]
A 25 ºC, as concentrações em mol/L de H+ e OH- na água pura são iguais entre si e apresentam um valor igual a 10-7 mol/L.
Água pura a 25 ºC [H+] = [OH-] = 10-7 mol/L
Em seguida, pergunte aos alunos o que é o produto iônico da água. Após ouvir as respostas dos alunos, explique se considerarmos o equilíbrio da água:

sua constante de ionização corresponde ao Kw e é expressa por:
Kw = [H+] . [OH-] a 25 ºC Kw = (10-7) . (10-7) ⇔ Kw = 10-14
Peça para que cada grupo pesquise na internet sobre a acidez da água. O objetivo é que os alunos descubram que a água não é acida e nem básica e sim neutra. Em seguida explique aos alunos, que na água as concentrações de H+ e OH- são sempre iguais, independente da temperatura; por esse motivo,a água é neutra. Quaisquer soluções aquosas em que [H+] = [OH-] também serão neutras.
Obs.: professor, lembre-se que estamos falando da substância água e não do material água.
Agora que os alunos já aprenderam o que é o produto iônico da água, disponibilize a tabela abaixo para cada grupo.
| Temperatura (ºC) | Kw x 1014 |
| 0 | 0,12 |
| 5 | 0,19 |
| 10 | 0,29 |
| 15 | 0,45 |
| 20 | 0,68 |
| 25 | 1,01 |
| 30 | 1,47 |
| 35 | 2,09 |
| 40 | 2,92 |
| 45 | 4,02 |
| 50 | 5,48 |
Tabela do Produto Iônico da Água em várias temperaturas
Peça para que os alunos analise os valores do produto iônico da água e da temperatura e criem uma relação entre essas duas grandezas. Solicite que um dos grupos diga qual a relação existente. Em seguida, explique que o aumento da temperatura provoca um aumento na ionização das moléculas da água e por consequência aumenta o seu produto iônico.
Sistematizando a aula: (20 min.)
Leia as questões com os alunos e disponibilize o restante da aula para os alunos responderem as questões abaixo:
- De acordo com a simulação, qual a diferença entre a constante de ionização (Ka) e a constante de equilíbrio (Keq)?
- Escreva a equação que representa o equilíbrio químico da água.
- O que é produto iônico da água?
- Qual relação existe entre o produto iônico da água e a temperatura?
Atividade Complementar:
Como complemento a essa aula, o professor poderá trabalhar com o conteúdo sobre pH e indicadores utilizando o experimento abaixo:
pH e indicadores caseiros
Indicadores
Preparando o indicador:
Corte aproximadamente 500 mililitros de repolho roxo em cubos de cerca de 2cm e coloque num liqüidificador ou processador. Acrescente aproximadamente 250 mililitros de água e deixe bater até que o repolho fique cortado uniformemente em pedaços minúsculos. Passe a mistura por uma peneira fina. Esse será nosso extrato de repolho roxo para explorar ácidos e bases.
Primeiro teste
Examine o rótulo de uma garrafa de vinagre branco. O rótulo provavelmente dirá que "contém ácido acético". Isso indica que aquele vinagre é um ácido e tem propriedades de um ácido. Vejamos como este ácido se comporta ao receber nosso extrato de repolho roxo.
Coloque 125 mililitros de vinagre em um vidro incolor (copo transparente). Acrescente 5 mililitros (1 colher de chá) de extrato de repolho roxo; mexa bem a mistura e note sua cor. A cor da mistura é:
[Coloque sua resposta na caixa acima]
A cor do extrato de repolho com vinagre é a cor que o extrato sempre terá quando misturado com um ácido. Guarde a mistura deste vidro para servir de referência para as próximas experiências.
Segundo teste
Agora vamos examinar o efeito sobre a cor do nosso extrato, sobre a amônia da água de lavadeira.
Coloque 125 mililitros da água amoniacal de lavar roupa em um vidro incolor. Acrescente 5 mililitros do extrato de repolho roxo e mexa bem a mistura. A cor desta nova mistura é:
[Coloque sua resposta na caixa acima]
A amônia contida na água de lavar roupa é uma base (substância alcalina). A cor desta mistura é a cor que nosso extrato sempre terá quando misturado com uma base. Guarde este novo frasco para usar sua cor como referência nas próximas experiências.
O extrato de repolho roxo, por indicar se uma substância tem as propriedades de um ácido ou de uma base, pode ser chamado de indicador de ácido/base.
Terceiro teste
Para testar as propriedades de um sólido escolhemos o bicarbonato de sódio.
Coloque 5 cm3 de bicarbonato de sódio (pó branco usado para acidez estomacal) em um vidro incolor e acrescente 125 mililitros de água. Agite a mistura até que o bicarbonato dissolva totalmente. A seguir, acrescente 5 mililitros de extrato de repolho roxo nesta solução. A cor desta mistura é:
[Coloque sua resposta na caixa acima]
pH
O extrato de repolho roxo mostrará cores diferentes para valores de pH diferentes. Essas cores e os correspondentes valores (aproximados) de pH são:
| pH aproximado | 2 |
4 |
6 |
8 |
10 |
12 |
| cor do extrato |
vermelho |
púrpura | violeta | azul | azul/verde | verde |
Com base nesta tabela, qual o pH (aproximado) do nosso vinagre?
Qual o pH (aproximado) de nossa água de lavadeira?
Qual o pH (aproximado) de nossa solução de bicarbonato de sódio?
Use das instruções utilizadas para o caso do vinagre e da amônia para testar o pH de vários outros líquidos incolores como dos refrigerantes (bebida suave de lima-limão) e suco de limão.
Anote suas observações.
Outros testes
Pode-se testar líquidos que são brancos (como é o caso do leite) da mesma maneira. Você também pode testar sólidos que se dissolvam na água, seguindo as instruções para o caso do bicarbonato de sódio. Isto também funciona para líquidos viscosos como é o caso de detergentes líquidos.
Teste outras substâncias de fácil obtenção como: açúcar, sal de cozinha, shampoo, leite de magnésia, tabletes antiácidos e aspirina. Em cada caso, anote numa tabela como a sugerida abaixo:
| Material | ||
| Cor do extrato | ||
| pH |
PRECAUÇÃO: Alguns produtos domésticos podem causar irritação da pele. Não permita que eles entrem em contato com sua pele; caso isso acontece lave abundantemente com água corrente.
Avaliação
Quatro estrelas 2 classificações
- Cinco estrelas 1/2 - 50%
- Quatro estrelas 0/2 - 0%
- Três estrelas 1/2 - 50%
- Duas estrelas 0/2 - 0%
- Uma estrela 0/2 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
EVELYN, Etec Centro paula souza - cidade do livro , São Paulo - disse:
evelynjeanneschulz@hotmail.com06/10/2014
Cinco estrelasmuuuuito bom! utilizamos na nossa aula
-
Odemar, CEFET , Rio de Janeiro - disse:
odemar.uerj@bol.com.br24/03/2010
Três estrelasMaterial bom. Faltam ilustrações
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


 Constante de equilíbrio
Constante de equilíbrio