27/01/2010

|

|

|
Eziquiel Menta, Rosangela Menta Mello
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
O que o aluno poderá aprender com esta aula
Apesar das inúmeras diferenças existentes, o aluno aprenderá que existe algo comum entre eles, pois tanto o grafite quanto o diamante possuem apenas átomos de carbono em sua estrutura. A esse fenômeno todos os cientistas do mundo inteiro chamam de Alotropia, dizemos então que a grafite e o diamante são algumas variedades alotrópicas do elemento químico carbono.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
- A diferença entre:
* Átomos e Moléculas
- Tipos de Substâncias:
* Substâncias Simples
* Substâncias Compostas
Estratégias e recursos da aula
Olá Professor !
Inicie a aula problematizando a seguinte questão com os alunos:

- Existe realmente algo em comum entre a grafite e o diamante, ou será que ambos são encontrados em abundância na natureza.
- Será que é a grafite ou o diamante que conduz corrente elétrica, ou será que os dois possuem boa condutividade elétrica.
- Ambos podem serem formados pelo mesm o elemento químico

1 ) A imagem abaixo demonstra a Grafite e o Diamante na sua Forma Estrutural.
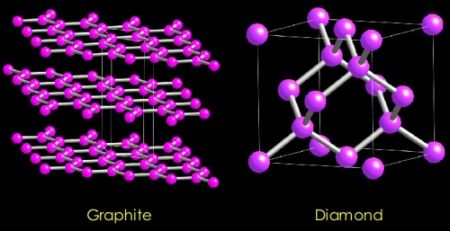

Fonte: http://www.infoescola.com/files/2009/08/4a7ccarbon_phases.jpg acessado 04/11/09
2) A imagem abaixo demonstra a Grafite e o Diamante na sua Forma Bruta

3 ) A imagem abaixo demonstra a Grafite e o Diamante na sua Forma Lapidada


Fonte: http://fisicamoderna.blog.uol.com.br/images/diamante_grafite.jpg acessado 04/11/09


O carbono é um elemento extremamente notável por inúmeras razões. As formas alotrópicas incluem na verdade, uma das substâncias mais frágeis e baratas (grafite) uma das mais duras e caras (diamante). Mesmo assim: apresenta uma grande afinidade para combinar-se quimicamente com outros átomos pequenos, incluindo átomos de carbono que podem formar largas cadeias. O seu pequeno raio atômico permite-lhe formar cadeias múltiplas; assim, com o oxigênio forma o dióxido de carbono, vital para o crescimento das plantas; com o hidrogênio forma numerosos compostos denominados, genericamente, hidrocarbonetos, essenciais para a indústria e o transporte na forma de combustível derivados de petróleo e gás natural. Que quando combinados formam uma grande variedade de compostos, por exemplo, os ácidos graxos essenciais para a vida, e os ésteres que dão sabor às frutas etc.
Na verdade a grafite é um material muito mole, utilizado na fabricação de lápis, como também de fibras de grande resistência, apresenta uma boa condutividade elétrica, e por ser abundante na natureza, também é utilizado na confecção de eletrodos eficientes e baratos no mercado.
Já o diamante é considerado um dos materiais mais duros que existem no nosso planeta, não conduz corrente elétrica, não é abundante, tem um valor comercial muito caro.Portanto dizemos que a grafite e o diamante são algumas variedades alotrópicas do elemento químico do carbono, a esse fenômeno denominamos de alotropia, em que o mesmo elemento químico constitui substâncias simples diferentes.

1) Raio laser transforma grafite em diamante, por um instante
"Mike Wofsey - Physical Review Focus - 18/08/2008"
Um flash de luz pode alterar temporariamente a estrutura do grafite. Uma equipe de pesquisadores, que acaba de publicar um artigo a respeito em uma das mais importantes revistas de Física do mundo, descobriu que pelo menos por um breve momento - a exposição à luz altera as ligações químicas no grafite para formar uma estrutura similar à do diamante.
2) Transformando carvão em diamante
Avanços posteriores poderão permitir uma conversão completa do grafite - que é uma forma de carvão - em diamante. Esta pesquisa poderá levar a novas técnicas em nano escala nas quais um laser constrói estruturas de diamante e grafite sobre a superfície de uma película de carbono.Embora blocos de diamantes industriais possam ser fabricados por meio de reações químicas, não há atualmente uma maneira de converter a forma grafite do carbono na estrutura do diamante em filmes finos.
3) COMO SE FAZ UM DIAMANTE EM LABORATÓRIO
A produção de pedras sintéticas dura cerca de quatro dias
* Um diamante verdadeiro é feito de carbono. No processo em laboratório, uma porção de grafite serve como fonte de carbono para produzir a gema sintética?
* Uma câmara de cerâmica é usada para reproduzir as condições geológicas que formam um diamante.
* O grafite é colocado na câmara, junto com um solvente de metal e fragmentos de diamantes verdadeiros, chamados de "sementes"
* A temperatura interna da câmara é eleva da a 1.600 graus Celsius, e a pressão é elevada a 58.000 atmosferas
* O calor e a pressão levam o grafite - que é carbono puro - a se quebrar em átomos.
* As sementes de diamante atraem os átomos de carbono para a parte mais fria da câmara. Os átomos fundem-se com as sementes, formando camadas cristalizadas .
* O resultado dessa cristalização é o diamante sintético (acima, as pedras amarelas da Gemesis), que terá de ser lapidado e polido, como os diamantes naturais.

Fonte: Gemesis Corporation http://revistaepoca.globo.com/Revista/Epoca/0,,EDG76270-6014,00-A+FORMULA+DO+DIAMANTE+PERFEITO.html acessado 05/11/09< /strong>
4) Uma das variedades alotrópicas é o Futeboleno, nesta imagem abaixo mostra de forma tridimensional a fórmula estrutural da molécula de Futebole
Fonte: http://portaldoprofessor.mec.gov.br/storage/recursos/10801/c60.jpg acessado 17/11/09

Inovação Tecnológica / Tudo o que acontece na fronteira do conhecimento
http://www.inovacaotecnologica.com.br/index.php acessado 05/11/09
Revista Época: A fórmula do diamante perfeito
SARDELLA, Antonio; Curso Completo de Química. São Paulo: Edito ra Ática, 2º Edição 1999LEMBO ; Química Realidade e Contexto. São Paulo: Editora Ática, 1º Edicação / 6º Impressão 2004
Atkins, P.; Jones, L. Princípios de química: questionando a vida moderna e o meio ambiente. Editora Bookman, 2001.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Futeboleno | Imagem |
Recursos Complementares

É muito importante que você conheça e consiga visualizar os diversos tipos de Alotropias que existem, pois os átomos são os mesmo, mas as substâncias são diferentes.
1) Estrutura Cristalina: A Valência dos Elementos e o Empacotamento
http://www.youtube.com/watch?v=dPjCpUh-TdY acessado 05/11/09
2) Estrutura Cristalina: Alotropia e Fulerenos
http://www.youtube.com/watch?v=mP-SbYlEp2U acessado 05/11/09
3) Os diamantes estão longe de perder o brilho. Pelo menos é o que afirma uma das maiores gigantes do mundo, a De Beers, veja o Vídeo abaixo:
http://www.youtube.com/watch?v=bD-c9xJ1tDs acessado 05/11/09
Avaliação
Logo após ter explicado todo o conteúdo da sua aula, aplique de surpresa para seus alunos duas questões que foram cobradas no vestibular referente a Alotropia.
1) (UFSE) Alotropia é o fenômeno que envolve diferentes substâncias:
X (a) simples, formadas pelo mesmo elemento químico.
(b) compostas. formadas por diferentes elementos químicos.
(c) Simples, com a mesma atomicidade.
(d) compostas, com a mesma fórmula molecular.
(e) compostas, formadas pelos elementos químicos.
2) (MACK-SP) São exemplos, respectivamente, de alótropos e de substâncias compostas:
(a) H2O; H2O2 e NaCl; CaCO3
(b) O2; O3; Cl2; F2
(c) Grafite e Co; CO
X (d) O2; O3; KMnO4; Mg(OH)2
(e) Hg; Ag e (NH4)+; (H3O)+
Cinco estrelas 1 classificações
- Cinco estrelas 1/1 - 100%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Ana Paula Silva Oliveira, Colégio Estadual Edith Machado , Bahia - disse:
apsoliveira2007@hotmail.com08/05/2013
Cinco estrelasEsta aula é impecável.Explica de maneira muito simples conteúdos complexos e difíceis de ser assimilados pelos alunos.Parabéns!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


