30/11/2009
Marco G. B. Burlamaqui
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
O que o aluno poderá aprender com esta aula
- Identificar as principais características da substância enxofre;
- Descrever o ciclo do enxofre;
- Demonstrar a formação do dióxido de enxofre a partir de um experimento prático;
- Identificar as propriedades do dióxido de enxofre.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
- Elemento Químico;
- Representação das substâncias.
Estratégias e recursos da aula

Professor, antes de iniciar a aula prepare o experimento descrito na aula 2.


Aula 01: O enxofre
No laboratório de informática, divida a turma em grupos de três ou quatro alunos. Depois que os alunos se organizarem, peça para que eles pesquisem na internet, nos sites de busca, e/ou nos seus livros didáticos, informações sobre o elemento químico enxofre. Para direcionar os alunos, salve um documento de texto, com as informações abaixo, na área de trabalho de cada um dos computadores. Os alunos deverão completar esse documento com as informações pesquisadas.
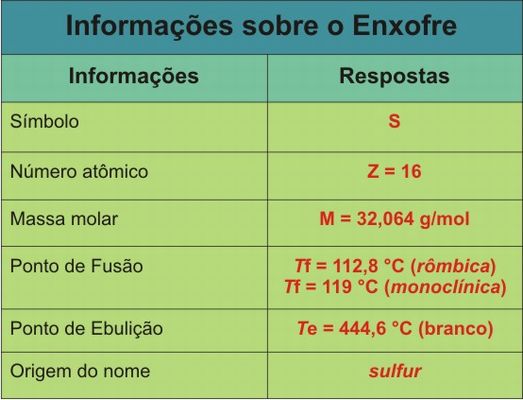
Tabela 1 – Informações sobre o Enxofre
Obs.: professor, você poderá selecionar outras perguntas para que os alunos possam responder.
Espere aproximadamente 15 minutos para que os alunos concluam a atividade.

Depois que os alunos localizarem as informações, eles deverão abrir a imagem abaixo e indicar quais são as atividades de aumenta a produção de dióxido de enxofre (SO2) no ar, isso também poderá ser feito através de uma pesquisa na internet.
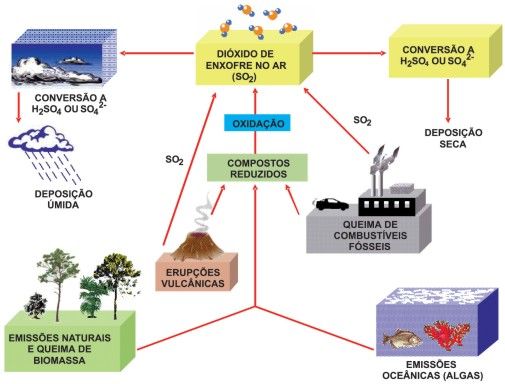
Figura 1 – Ciclo global do enxofre
Fonte: Revista Química Nova na Escola
http://qnesc.sbq.org.br/online/cadernos/05/quimica_da_atmosfera.pdf
Os alunos identificarão que a queima de biomassa, as erupções vulcânicas e a queima de combustíveis fósseis são responsáveis pelo aumento das emissões de dióxido d e enxofre (SO2).
Professor, utilize esse momento para explicar detalhadamente o ciclo do enxofre, considerando os fatores que aumentam as e missões de dióxido de enxofre na atmosfera. Após a explicação, e aproveitando que os alunos estão em grupos, peça para que eles façam um desenho do ciclo do enxofre indicando os fatores responsáveis pela emissão de SO2 na atmosfera. Esse desenho deverá ser feito em uma cartolina.
Em seguida, peça para que cada um dos grupos apresente o seu desenho para os outros alunos.
Professor, aproveite esse momento para avaliar parcialmente os alunos.

Aula 02: Formação de dióxido de enxofre
Depois de concluídas as atividades no laboratório de informática, leve os alunos para o Laboratório de Química. Distribua os alunos no laboratório, não há a necessidade de organizar os alunos em grupos.
Professor, você deverá preparar o experimento abaixo com antecedência:
MATERIAS
• 1 vidro com tampa (como os de maionese ou café solúvel);
• enxofre em pó (1 colher de chá cheia);
• 4 fitas de papel tornassol azul ( ~ 3 cm cada uma);
• 2 pétalas de flor colorida;
• 1 colher de plástico;
• 2 pedaços de fios de cobre ( ~ 15 cm cada um);
• 1 caixa de fósforos;
• 1 caneta.
PROCEDIMENTOS
1. Coloque uma fita de papel tornassol e uma pétala de flor na parte de dentro da tampa do vidro. Utilizando a colher de plástico, polvilhe um pouco do enxofre em pó sobre a fita e sobre a pétala (não utilize todo o enxofre, apenas o suficiente para manchar parte do papel tornassol e da pétala de flor). Anote suas observações na tabela de resultados.
2. Coloque cerca de 5 cm de água da torneira no vidro, e com o auxílio da colher (limpa), retire um pouco de água e coloque sobre o enxofre que está sobre a pétala e o papel tornassol. Observe o que acontece com a água em contato com o enxofre, e se houve alteração na cor do papel tornassol e na pétala. Anote suas observações. Jogue no lixo o material sólido da tampa e lave a tampa.
3. Pegue uma nova fita de papel tornassol e o umedeça com água. Anote suas observações.
4. Monte o seguinte esquema Coloque em uma das extremidades do fio de cobre uma nova pétala e um pouco separado coloque um novo papel tornassol azul. Na outra extremidade do fio, faça um pequeno gancho e pendure por dentro do vidro que já tem um pouco de água. Tome cuidado para que a pétala ou fita não entrem em contato com a água. Veja a ilustração.
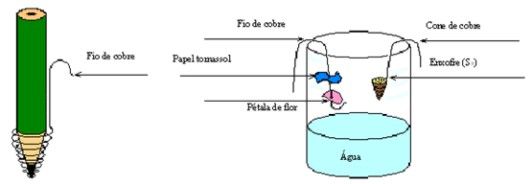
5. Pegue o outro fio de cobre e enrole parte deste na ponta da caneta, formando um pequeno cone de cerca de 1 cm. Faça um pequeno gancho na outra ponta do fio, retire a caneta e encha o cone com enxofre em pó, com cuidado (use a colher). Pendure o fio de cobre por dentro do vidro (sem atingir a água).
6. Posicione um fósforo aceso abaixo do cone para iniciar a queimar o enxofre e rapidamente retire o fósforo e tampe o vidro. Observe se o enxofre está realmente queimando. Aguarde 5 minutos e anote na tabela de resultados se houve mudança na coloração do papel e da pétala.
7. Retire os fios de cobre de dentro do vidro rapidamente. Feche o vidro e agite a solução cuidadosamente.
8. Umedeça nova fita de papel tornassol na água e anote suas observações.
Obs.: O papel tornassol azul é de cor azul em meio neutro e básico e se torna rosa em meio ácido.
Experimento adaptado do site: http://www.usp.br/qambiental/chuva_acidaExperimento.html
Antes de fazer o experimento para os alunos, mostre o enxofre em pó para eles e informe que será feito um experimento utilizando essa substância. Em seguida entregue para os alunos uma folha contendo a tabela abaixo que deverá ser preenchida com as observações feitas ao longo do experimento.
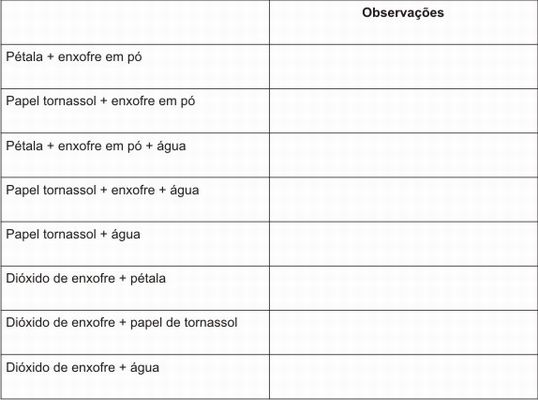
Tabela 2 - observações do experimento

1. Por que não há alteração na cor da pétala ou do papel tornassol no contato com enxofre em pó e com a água?
2. Por que após a combustão do enxofre, a pétala e o papel tornassol mudam de cor?
3. Por que a água do experimento se tornou ácida?
Recursos Complementares
Artigos da Revista Química Nova na Escola
Professor, utilize esses artigos para obter mais informações sobre o elemento Enxofre.
- Elemento Químico: Enxofre
http://qnesc.sbq.org.br/online/qnesc16/v16_A12.pdf
- Ciclos Globais de Carbono, Nitrogênio e Enxofre:
http://qnesc.sbq.org.br/online/cadernos/05/quimica_da_atmosfera.pdf
Sugestão de Simulação
Professor, você poderá utilizar a simulação como uma atividade complementar em aula posterior
- Draculamania
http://portaldoprofessor.mec.gov.br/fichaTecnica.html?id=12401
Avaliação
Os alunos serão avaliados através da correção da participação ao longo da aula e através da correção da tabela 2 e das questões propostas na sistematização da aula.
Cinco estrelas 1 classificações
- Cinco estrelas 1/1 - 100%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Denise, IFMA , Maranhão - disse:
denisearrais2006@hotmail.com30/10/2013
Cinco estrelasmuito legal.. parabéns..
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


