14/01/2009
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
O que o aluno poderá aprender com esta aula
• Diferenciar as Leis das Reações Químicas.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Estratégias e recursos da aula
Professor, nesta aula vamos mostrar aos alunos as Leis das Reações Químicas. Para isso, utilizaremos um experimento demonstrativo e um recurso educacional digital.


Professor inicie a aula com o experimento demonstrativo abaixo:
Materiais
- Uma palha de aço;
- Uma caixa de fósforo;
- Um vidro de relógio;
- Uma balança digital.
Procedimentos
Coloque a balança em um local de fácil visão para todos os alunos. Em seguida coloque sobre o prato da balança a palha de aço. Peça para um dos alunos falar a massa registrada na balança e anote-a no quadro, depois disso pegue a palha de aço e coloque sobre o vidro de relógio e coloque fogo com cuidado. Após o término da combustão, coloque a palha de aço novamente sobre o prato da balança. Por fim, peça para outro aluno falar a massa registrada na balança anotando-a no quadro.
Obs.: Medindo a massa da palha de aço antes e depois de sua queima, observa-se o aumento da massa do material sólido; mas, somando-se a massa do gás oxigênio que reage com o ferro, constata-se o previsto pela Lei de Lavoisier.

Após o experimento, pergunte aos alunos o que aconteceu para a massa do material queimado aumentar em relação à massa da palha de aço. Escreva essa pergunta no quadro e peça para os alunos copiarem. Provavelmente, os alunos não encontrarão a resposta, por isso diga a eles que terão que pesquisar na internet para responder a essa pergunta. Conduza os alunos para o laboratório de informática. Divida a turma em função da quantidade de computadores no laboratório.

Peça para os alunos pesquisarem sobre o experimento feito pelo professor e sobre a pergunta que eles copiaram. Diga aos alunos para que entreguem a pergunta respondida no final da pesquisa.
Recolha as respostas e explique aos alunos que esse fenômeno pode ser explicado a partir das Leis das Reações Químicas. Aproveitando os computadores, peça para que os alunos pesquisem este termo: Leis das Reações Químicas. Após a pesquisa, leia a respostas entregues pelos alunos e caso não tenha a resposta correta explique que esse fenômeno pode ser explicado pela Lei da Conservação das Massas ou Lei de Lavoisier. Explique aos alunos que a massa da palha de aço aumentou, pois não levamos em consideração a massa do gás oxigênio que se encontra na atmosfera, de acordo com a reação abaixo:
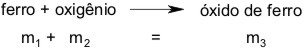
Sendo assim a balança não registrou a massa do oxigênio antes da queima, mas depois da queima o oxigênio reagiu com o ferro formando óxido de ferro e essa massa foi registrada. A Lei de Lavoisier diz que existe uma quantidade igual de matéria antes e depois do experimento, a quantidades dos átomos permanecem precisamente as mesmas e nada acontece além de mudanças e modificações nas combinações desses átomos. Essa lei pode ser resumida pela frase:

Após essa explicação, diga aos alunos que essa é a primeira lei das reações químicas. Pergunte qual é a outra lei que eles pesquisaram na internet. Provavelmente responderão: Lei das Proporções de Massas ou Lei de Proust.
Peça para que os alunos abram simulação abaixo que fala sobre a Lei de Proust:
A Construção
 A construção
A construção
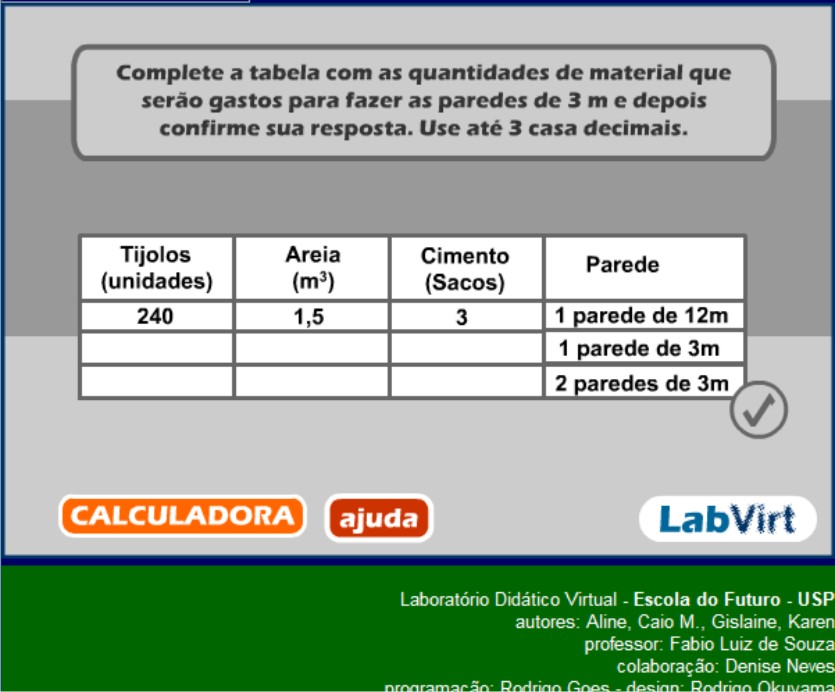
Durante a simulação circule pela sala e tire as dívidas dos alunos. Reproduza a tabela acima no quadro e após o término da simulação complete-a juntos com os alunos. A simulação explica o que vem a ser a Lei das Proporções definidas, mas mesmo assim diga aos alunos que:

Para finalizar a aula, peça para os alunos pesquisarem mais sobre esse assunto na internet e fazer um resumo sobre o que foi encontrado.

Para trabalhar a parte matemática do conteúdo, peça para que os alunos respondam as questões abaixo:
- Sabendo que na combustão completa de 50 g de magnésio metálico são consumidos 33 g de gás oxigênio, responda:
a) Que massa de oxigênio é necessária para queimar 150 g de magnésio?
b) Qual a massa de óxido de magnésio formada pela reação entre 600 g de magnésio com 396 g de oxigênio?
- Num experimento feito em laboratório, realizou-se a combustão da palha de aço em um recipiente aberto, inicialmente, a massa da palha de aço era de 3,0 g e, após a queima, a massa resultante obtida foi de 3,4 g. Explique por que esse valor obtido não invalida a Lei da Conservação das Massas.

Para prosseguir no conteúdo o professor poderá utilizar o recurso educacional digital abaixo para trabalhar o conteúdo Balanceamento Químico:
A Química dentro de um bolo
 A química dentro de um bolo
A química dentro de um bolo
Recursos Educacionais
| Nome | Tipo |
|---|---|
| A química dentro de um bolo | Animação/simulação |
| A construção | Animação/simulação |
Avaliação
Cinco estrelas 3 classificações
- Cinco estrelas 3/3 - 100%
- Quatro estrelas 0/3 - 0%
- Três estrelas 0/3 - 0%
- Duas estrelas 0/3 - 0%
- Uma estrela 0/3 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
glaucia, E. E. PRESIDENTE TANCREDO NEVES , Minas Gerais - disse:
glausancastro@yahoo.com.br08/09/2014
Cinco estrelasmuito significativa
-
li, África do Sul - disse:
ksdmd@hotmail.com06/05/2012
Cinco estrelasmuito util
-
Edenildo Gomes Ribeiro, EEM MARIA CELESTE DE AZEVEDO PORTO , Ceará - disse:
edenildogr@gmail.com07/05/2010
Cinco estrelasCara amei essa aula. Muito boa, os alunoa adoraram.
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


