17/12/2009
Edson Luis Nunes, Daniel Rodrigues Ventura, Isnard Domingos Ferraz, José Ângelo de Faria.
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Física | Calor, ambiente e usos de energia |
O que o aluno poderá aprender com esta aula
Entender a transformação isométrica.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Temperatura na escala Absoluta (ou Kelvin), calor, pressão, volume, Lei de Charles, gases perfeitos e 1a Lei da Termodinâmica.
Estratégias e recursos da aula
Comece lembrando aos alunos que, uma máquina térmica nada mais é que um conjunto de transformações termodinâmicas, que acontecem numa ordem específica, com o objetivo de transformar energia térmica em trabalho. Dê como exemplo geral a locomotiva a vapor e o barco a vapor.
Diga também que, das 4 transformações termodinâmicas particulares que geralmente se aprende em termodinâmica (isotérmica, isométrica, adiabática e isobárica) esta, a isométrica, é a única que não envolve trabalho recebido nem realizado.
Faça agora uma breve revisão sobre a Lei de Charles. Depois faça a seguinte sequência de perguntas para os alunos, sempre discutindo a resposta correta com eles. Entre colchetes está uma das prováveis respostas corretas apenas para orientação do professor:
1) suponha um recipiente de volume bem definido (invariável). O que acontece com um gás, contido nesse recipiente, quando se fornece uma certa quantidade Q de energia térmica para esse gás? [o gás aumenta de temperatura...]
2) como o volume do recipiente é invariável, qualquer objeto colocado sobre o ele não se moverá, ou seja, não haverá a realização de trabalho. Pergunta-se, o que aconteceu com a energia Q fornecida ao sistema? [provocou o aumento na temperatura do gás...]
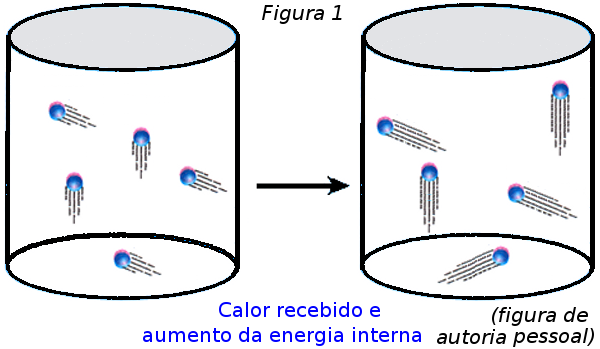
Explique agora para eles o que acontece com o sistema, esquematicamente, por intermédio da Figura 1. Depois, matematicamente, à luz da 1a Lei da Termodinâmica, usando os passos abaixo:
a) se não houve realização de trabalho então τgás = 0;
b) a energia Q que entrou no sistema provocou aumento de energia interna, então ΔU > 0 (houve aumento na temperatura do gás);
c) matematicamente, o que aconteceu pode ser calculado da seguinte maneira:
ΔU = Q – τgás → ΔU = Q – 0 → ΔU = Q.
Dê agora em exemplo de aplicação prática.
Diga aos alunos que esta transformação é uma isométrica e é o que acontece, aproximadamente, no pistão de um automóvel, quando o combustível é detonado pela centelha da vela, liberando energia térmica. Antes do pistão se mover para cima essa energia térmica liberada produz um aumento da energia interna do gás oxigênio no interior do sistema, processo este isométrico.
Ela acontece também quando da abertura da válvula de escape que provoca a queda na pressão interna e saída dos gases, sem variação do volume (apesar da perda de gás).
Peça a eles agora para discutirem entre si o processo inverso, ou seja, levando-se em consideração o mesmo recipiente, o que acontece quando se retira energia térmica do sistema, dado que o recipiente não var ia de volume. Peça pa ra usarem a seguin te c onvenção:
-- aumento da energia interna do sistema é positivo (ΔU> 0);
-- redução da energia interna do sistema é negativo (ΔU &l t; 0);
-- calor recebido pelo sistema é positivo (Q &g t; 0);
-- calor fornecido pelo sistema é negativo (Q < 0).
Analise depois os resultados a que eles chegaram ao final das discussões. É preciso que concluam que, no processo inverso ΔU = Q e τgás = 0, mas ΔU < 0 e Q < 0. Se não chegarem a essa conclusão o professor deve intervir e conduzi-los a ela, usando a Figura 2.
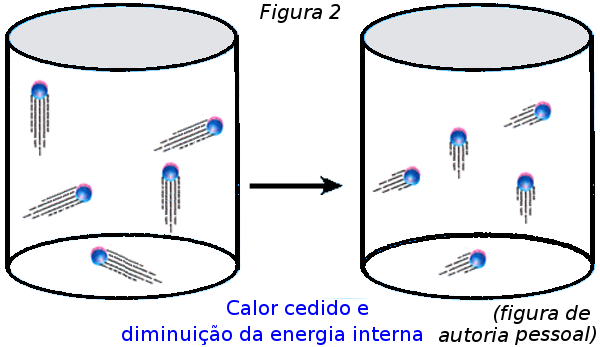
Diga a eles que esta transformação também recebe o nome de isovolumétrica ou isocórica.
Para finalizar discuta comparativamente, à luz da convenção citada, que no primeiro caso ΔU e Q têm sinais positivos (Q > 0, pois o sistema recebeu calor e, ΔU > 0, pois houve aumento da energia interna do sistema, portanto aumento da temperatura do gás) e que na situação inversa ΔU e Q têm sinais negativos (Q < 0, pois o sistema cedeu calor e, ΔU < 0, pois houve redução da energia interna do sistema, portanto redução da temperatura do gás).
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Transformações gasosas | Animação/simulação |
Recursos Complementares
Aprenda mais sobre a Transformações isométricas:
BrasilEscola: http://www.brasilescola.com/fisica/principio-termodinamica.htm
Simulador Stefanelli : http://www.stefanelli.eng.br/webpage/simtermo/p_sim_tp.html
Wikipedia : http://pt.wikipedia.org/wiki/Termodin%C3%A2mica
NEWTON, V.B; HELOU, R.D.; GUALTER, J.B. Tópicos de Física 2 – Termologia, Ondulatória e Óptica. São Paulo: Editora Saraiva, Vol. 2, 448p., 18a Ed., 2007.
Avaliação
Elabore questões teóricas e práticas sobre esse assunto. Nas questões teóricas explore a relação entre pressão e temperatura quando não há variação no volume do gás contido no recipiente. Nas questões práticas faça os alunos realizarem cálculos que envolvam a equação que explica matematicamente a 1a Lei da Termodinâmica quando aplicada a transformações isométricas, tanto na entrada quanto na saída de energia térmica do sistema.
Sem estrelas 0 classificações
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncie opiniões ou materiais indevidos!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus



