27/01/2010
Edson Luis Nunes, Daniel Rodrigues Ventura, Isnard Domingos Ferraz, José Ângelo de Faria.
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Física | Calor, ambiente e usos de energia |
O que o aluno poderá aprender com esta aula
Entender a transformação isobárica e a importância dela no estudo das máquinas térmicas.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Temperatura na escala Absoluta (ou Kelvin), calor, pressão, volume, Lei de Boyle, Lei de Charles, Lei de Charles/Gay-Lussac, Equação de Clapeyron, gases perfeitos e 1a Lei da Termodinâmica.
Estratégias e recursos da aula
Comece dizendo aos alunos que as transformações termodinâmicas mais simples são a isotérmica, a isovolumétrica e a adiabática pois nelas sempre há uma variável da primeira Lei da Termodinâmica que possui variação nula (na isotérmica ΔU = 0; na isométrica τgás = 0; na adiabática Q = 0). Portanto, a análise dessas transformações e a aplicação da Equação do Princípio da Conservação de Energia se torna simples. Mas, pergunte a eles o seguinte: será que não há uma transformação um pouco mais complexa, onde ocorra variação nas três variáveis?
Diga que sim e que esta transformação é a isobárica.
Faça inicialmente uma breve revisão da Lei de Charles/Gay-Lussac. Depois faça a seguinte sequência de perguntas para os alunos, sempre discutindo a resposta correta com eles. Entre colchetes está uma das prováveis respostas corretas apenas para orientação do professor:
1) suponha um recipiente de volume facilmente variável (dotado de êmbolo móvel). O que acontece com o gás contido nesse recipiente quando ele recebe calor e se expande mas, sem que haja variação na sua pressão? [o gás aumenta de volume, realizando trabalho...]
2) suponha agora que, sobre este êmbolo há um objeto, um tijolo, por exemplo. Com a movimentação do êmbolo este tijolo será movido para cima, ou seja, ele receberá trabalho. Pergunta-se, o que aconteceu com a energia interna ΔU do sistema? [reduziu-se transformando-se em trabalho realizado sobre o tijolo...]
3) o que esta transformação tem de diferente das transformações isotérmica, isométrica e adiabática? [nas três transformações citadas sempre uma das variáveis da 1a Lei da Termodinâmica possui valor nulo, nessa transformação nenhuma dessas variáveis é nula. Outra diferença é que nas três transformações citadas sempre ocorria transformação de apenas um tipo de energia em apenas outro tipo de energia, mas na isobárica o calor que entrou no sistema se transformou tanto em trabalho como energia interna...].
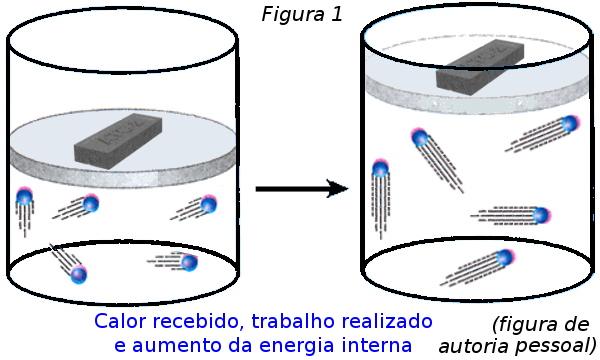
Explique agora para eles o que acontece com o sistema, esquematicamente, por intermédio da Figura 1, depois, matematicamente, à luz da 1a Lei da Termodinâmica, usando os passos abaixo:
a) houve recebimento de energia térmica pelo gás (então Q > 0);
b) a energia interna do sistema aumentou (ΔU > 0, pois houve aumento da temperatura do gás);
c) houve realização de trabalho sobre o meio (τgás > 0, pois houve elevação do tijolo);
c) matematicamente, o que aconteceu pode ser calculado da seguinte maneira:Q = ΔU + τgás.
Dê agora exemplos de aplicação prática.
Diga aos alunos que esta transformação é uma isobárica e é o que acontece, aproximadamente, no pistão de um automóvel, quando ele realiza a admissão da mistura de ar e combustível, à baixa pressão, para depois detoná-la com a centelha da vela. A pressão é praticamente constante devido à velocidade do movimento do pistão, por isso, o processo pode ser considerado isobárico.
Semelhantemente é o que acontece na expulsão dos gases resultantes após a queima do combustível. O movimento do pistão empurra os gases remanescentes, provocando diminuição do volume. Devido à velocidade com que ocorre a diminuição do volume esse processo é também considerado isobárico.
Peça a eles agora para discutirem entre si o processo inverso, ou seja, levando-se em consideração o mesmo recipiente, o que acontece quando se fornece trabalho para o sistema e se retira energia térmica do sistema, mas à pressão constante. Peça para usarem a seguinte convenção:
-- calor recebido pelo sistema é positivo (Q > 0);
-- calor fornecido pelo sistema é negativo (Q < 0);
-- trabalho realizado pelo sistema é positivo (τgás > 0);
-- trabalho recebido pelo sistema é negativo (τgás < 0);
-- aumento da energia interna do sistema é positivo (ΔU> 0);
-- redução da energia interna do sistema é negativo (ΔU < 0).
Analise depois os resultados a que eles chegaram ao final das discussões. É preciso que concluam que, no processo inverso Q = ΔU + τgás mas Q < 0, ΔU < 0 e τgás < 0. Se não chegarem a essa conclusão o professor deve intervir e conduzi-los à essa conclusão, mostrando a Figura 2.
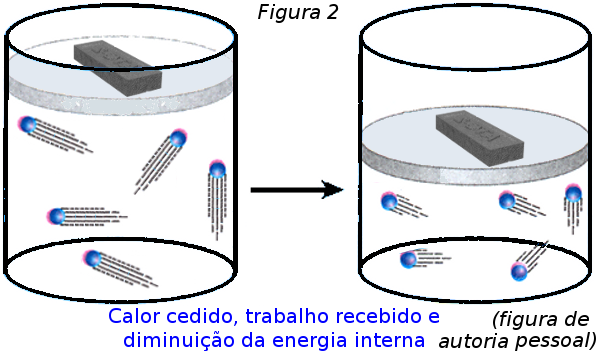
Para finalizar discuta comparativamente, à luz da convenção citada, que no primeiro caso Q, ΔU e τgás têm sinais iguais (positivos), a saber:
-- Q > 0 pois houve recebimento de calor pelo gás;
-- ΔU > 0 pois houve aumento da energia interna do sistema com aumento de temperatura do gás;
-- τgás > 0 pois houve trabalho realizado pelo sistema.
E que na situação inversa Q, ΔU e τgás também têm sinais iguais (porém negativos), a saber:
-- Q < 0 pois houve retirada de calor do gás;
-- ΔU < 0 pois houve diminuição d a energia interna do sistema com redução de temperatura do gás;
-- τgás < 0 pois houve tr abalho realizado sobre o sistema.
Na transformação isobárica, é necessário ensinar ainda aos alunos a forma de cálculo do trabalho realizado pelo gás, que chamaremos aqui de τpc (trabalho a pressão constante). O professor deve fazer uma breve revisão dos conceitos de trabalho e pressão vistos na primeira série, lembrando-os ao final de que τ = Fxd (trabalho é igual ao produto da força pela distância), e de que p = F / A (pressão é igual a força dividida pela área).
Após a revisão, faça no quadro a seguinte dedução:
τ = F x d; (Equação 1)
p = F / A → F = p x A; (Equação 2)
Substituindo-se a Equação 2 na Equação 1 tem-se: τ = p x A x d; (Equação 3)
Mas, o produto da distância d varrida pelo êmbolo (durante a expansão) pela área A do êmbolo, é, na verdade, a variação de volume sofrida pelo gás durante sua expansão, então: A x d = Δv. Substituindo-se este valor na Equação 3, pode-se concluir que τpc = p x ΔV; (Equação 4)
A Equação de Clapeyron (pV = nRT) pode ser re-escrita da seguinte forma: px ΔV = nRx ΔT;
Comparando-se a Equação 4 com esta nova forma da Equação de Clapeyron obtém-se as fórmulas de cálculo de trabalho na transformação isobárica: τpc = px ΔV = nRx ΔT.
Aqui, deixe claro para os alunos que estas fórmulas valem não só para expansão, mas também para compressão. A difer ença é que, na expansão o trabalho é positivo (τpc > 0) e na compressão o trabalho é negativo (τpc < 0), o que se justifica pois na expansão a variação de volume é positiva e na compressão a variação de volume é negativa.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Transformações gasosas | Animação/simulação |
Recursos Complementares
Aprenda mais sobre a Transformações isotérmicas:
BrasilEscola: http://www.brasilescola.com/fisica/principio-termodinamica.htm
Simulador Stefanelli : http://www.stefanelli.eng.br/webpage/simtermo/p_sim_tp.html
Wikipedia : http://pt.wikipedia.org/wiki/Termodin%C3%A2mica
NEWTON, V.B; HELOU, R.D.; GUALTER, J.B. Tópicos de Física 2 – Termologia, Ondulatória e Óptica. São Paulo: Editora Saraiva, Vol. 2, 448p., 18a Ed., 2007.
Avaliação
Elabore questões teóricas e práticas sobre esse assunto. Nas questões teóricas explore a relação entre volume e temperatura quando não há variação na pressão do gás contido no recipiente dotado de êmbolo móvel. Nas questões práticas faça os alunos realizarem cálculos que envolvam a equação que explica matematicamente a 1a Lei da Termodinâmica quando aplicada a transformações isobáricas, tanto na compressão quanto na expansão.
Cinco estrelas 1 classificações
- Cinco estrelas 1/1 - 100%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Sebastião Daniel Nunes, Pontifícia Universidade Católica de Minas Gerais , Minas Gerais - disse:
sdnunes@uol.com.br07/11/2010
Cinco estrelasÓtima, principalmente porque estava pesquisando para resolver uma questão do Mestrado e ajudou muito. Só posso agradecer.
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus





