01/04/2009
Eziquiel Menta
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Fundamental Final | Ciências Naturais | Vida e ambiente |
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
O que o aluno poderá aprender com esta aula
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Estratégias e recursos da aula

No dia a dia utilizamos diferentes tipos de latinhas seja de refrigerantes, cervejas ou outro produto qualquer. Devido ser leve e muito resistente o alumínio enquanto material ideal tem sido empregado dentre outras aplicações à confecção de embalagens. Pergunte ao estudantes de que material são feitas as latinhas que utilizamos no cotidiano. Leve-os a pensarem os diversos materiais disponíveis no mercado e a infinidade de metais encontrados na natureza. Após debaterem proponha à turma que desenvolvam um experimento.

Oriente os estudantes para que desenvolvam o experimento abaixo:
| Titulo do experimento: Experimentos com alumínio Objetivo: verificar os fatores que afetam a velocidade da reação de oxidação do alumínio em meio ácidoestudar. Material Na ausência de material de laboratório, a vidraria utilizada pode ser substituída por material alternativo, como copos de vidro ou de plástico. Da mesma forma, em todas as etapas pode ser utilizada a água da torneira. A concentração de ácido clorídrico na solução “limpa piso” é de aproximadamente 5 mol/L, tendo sido previamente determinada por titulação ácido-base. Por sua vez, a solução aquosa de soda cáustica foi preparada na concentração de 4 g/L (0,1 mol/L). No caso dos anéis de alumínio, além de ser um material de fácil aquisição e conhecido pelos alunos, outra grande vantagem do seu emprego é que eles apresentam, praticamente, uniformidade de massa e volume, o que contribui para os experimentos propostos. Procedimentos Em dois tubos de ensaio, adiciona se quantidades iguais de solução “limpa piso” e solução aquosa de soda cáustica (0,1 mol/L). Em seguida, simultaneamente, adiciona-se um anel de alumínio em cada tubo. O volume utilizado de cada solução deve ser de aproximadamente 1/3 do volume do tubo ou o equivalente para cobrir por completo os anéis de alumínio. Em ambos os tubos, deve ser observado o consumo do metal e intensa formação de gás. Através desses experimentos, é possível comprovar o caráter anfótero do alumínio, já que na solução “limpa piso” o reagente predominante é o ácido clorídrico, enquanto na soda cáustica é o hidróxido de sódio. As equações 1 e 2 representam os fenômenos químicos a serem observados para os meios ácido e básico, respectivamente. 1. A reação de oxidação do alumínio metálico em solução diluída de ácido clorídrico é um processo espontâneo (ΔG < 0). Discuta como os fatores entalpia (ΔH) e entropia (ΔS) contribuem para a espontaneidade da reação, a partir das observações experimentais e da respectiva equação química. |

As informações referente as questões abaixo e das observações devem ser relatadas no arquivo que está disponível no link: www.sitedaescola.com/aulas_inovadoras/marco_amaral/Relat%f3rio.doc

Oriente para que acessem a simulação “O processo do alumínio” e respondam as questões que foram alvo de debate. Neste recurso, será possível ao estudante identificar objetos compostos de alumínio que utilizamos no cotidiano. Link: <portaldoprofessor.mec.gov.br/showResource.action>


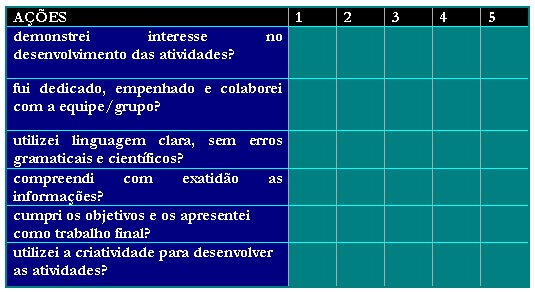
A auto-avaliação, por meio de rubrica pode colaborar para que o estudante avalie sua participação na aula. Assim, oriente para que a pocedam com base nos critérios abaixo que podem ser adaptados à realidade.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| O processo do alumínio | Animação/simulação |
Recursos Complementares
Avaliação
Sem estrelas 0 classificações
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncie opiniões ou materiais indevidos!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


 O processo do alumínio
O processo do alumínio