23/05/2010
Marco G. B. Burlamaqui
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
O que o aluno poderá aprender com esta aula
- Conceituar ligação covalente;
- Identificar os pares de elétrons isolados;
- Identificar os pares de elétrons compartilhados pelos átomos das moléculas em estudo;
- Utilizar a Estrutura de Lewis para representar as ligações químicas entre os átomos;
- Utilizar a Fórmula Estrutural para representar as ligações químicas das moléculas.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
- Ligação iônica;
- Representação das ligações iônicas;
- Compostos iônicos;
- Identificação da quantidade de elétrons na camada de valência através da distribuição eletrônica.
Estratégias e recursos da aula
Professor, leve para a sala de aula cartolinas, pincéis atômicos, canetas hidrográficas.
Aula 1:
Professor, inicie a aula relembrando com os alunos as características das ligações iônicas:
- Ligações iônicas ocorrem com íons;
- Os íons cátions são carregados positivamente e os íons ânions são carregados negativamente;
- Nesse tipo de ligação um átomo doa elétron(s) e o outro recebe.
Após uma revisão rápida sobre esse assunto, informe aos alunos que o modelo utilizado para explicar a ligação iônica assume que um átomo tem a tendência de doar elétron(s) e outro tem a tendência de receber elétron(s), com isso completando as suas respectivas camadas de valência com 2 ou 8 elétrons.
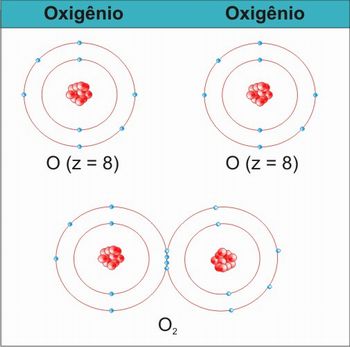
Em seguida, desenhe no quadro a representação química da molécula de oxigênio: O2. Peça para que os alunos identifiquem a quantidade de elétrons na camada de valência de cada um dos átomos de oxigênio, para isso, eles deverão fazer a distribuição eletrônica dos elétrons. Eles encontrarão que o oxigênio possui 6 elétrons na camada de valência. Pergunte aos alunos como esses dois átomos ligarem entre si, uma vez que o átomo de oxigênio tem a tendência de receber elétrons. É provável que os alunos respondam, de acordo com o modelo da ligação iônica, que um dos átomos doará elétrons.
Após ouvir as considerações dos alunos, explique que para explicar a ligação existente na molécula de oxigênio foi criado um modelo chamado de ligação covalente.
Professor, explique para os alunos que no modelo da ligação covalente devemos levar em consideração que quando os dois átomos de oxigênio se aproximam, surgem ao mesmo tempo, forças de atração e repulsão:
- os elétrons de dois átomos se repelem;
- os núcleos de dois átomos se repelem;
- o núcleo de cada átomo de oxigênio atrai o elétron do outro.
Essas forças atingem um equilíbrio. Não há transferência de elétrons de um átomo para o outro, ou seja, os elétrons de cada oxigênio continuam presos nas suas eletrosferas, compartilhados pelos dois átomos. Desse modo cada átomo de oxigênio passa a interagir com os quatro elétrons compartilhados, totalizando oito elétrons na camada de valência.
Figura 1 – Representação das ligações covalentes na molécula de oxigênio
Fonte: elaborada pelo autor
Após a explicação, divida a turma em grupos de três ou quatro alunos, caso a turma seja muito grande cada grupo poderá ter uma quantidade maior de componentes do que a indicada. Entregue para cada grupo uma cartolina e materiais para a confecção de cartazes (canetas hidrográficas, pincéis atômicos e outros). Informe para os alunos que eles deverão criar uma forma para representar a ligação covalente nas seguintes moléculas: H2, HCl, Cl2, O2, H2O. Cada grupo representará duas moléculas. Professor, você poderá indicar mais moléculas caso estas não sejam suficientes. Depois que os alunos concluírem o trabalho peça para que cada um dos grupos apresente para os demais alunos as formas como representaram as ligações covalentes das suas respectivas moléculas. Reserve o restante da primeira aula para essa atividade.
Professor, durante a apresentação dos grupos observe e faça anotações das principais dificuldades dos alunos.
Aula 02:
Depois das apresentações dos grupos, explique aos alunos que existem várias formas de representar as ligações covalentes, inclusive as que foram criadas por eles, mas o importante é que contenham algumas informações:
- a indicação dos elementos presentes na molécula;
- a indicação dos pares de elétrons compartilhados;
- a indicação dos pares de elétrons livres (não compartilhados).
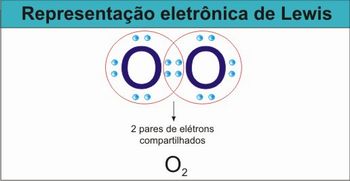
Essas informações são facilmente indicadas quando utilizamos como forma de representação a representação eletrônica de Lewis. Nela, indicamos apenas os elétrons da camada de valência de cada átomo, e os elétrons compartilhados são representados entre os símbolos dos átomos ligantes.
Figura 2 – Representação eletrônica de Lewis para a molécula de oxigênio
Fonte: elaborada pelo autor
Faça o desenho da representação eletrônica de Lewis da molécula de oxigênio no quadro, e identifique os pares de elétrons isolados e os pares de elétrons compartilhados.
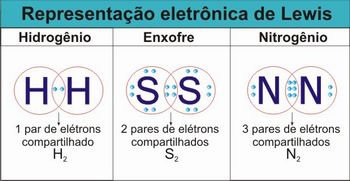
Depois da explicação, peça para que os alunos retomem os seus cartazes e indiquem os pares de elétrons isolados e os pares de elétrons compartilhados nas suas respectivas representações. Em seguida, explique que as ligações covalentes podem ser classificadas de acordo com a quantidade de pares de elétrons compartilhados:
- 1 par de elétrons compartilhados – ligação covalente simples;
- 2 pares de elétrons compartilhados – ligação covalente dupla;
- 3 pares de elétrons compartilhados – ligação covalente tripla.
Figura 3 – Representação eletrônica de Lewis para as moléculas de hidrogênio, enxofre e nitrogênio.
Fonte: elaborada pelo autor
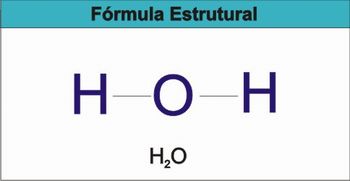
Em seguida, explique aos alunos que a representação Lewis é bastante útil, mas existe um jeito mais simples de representar as moléculas. No caso, os pares de elétrons são representados por barras e os elétrons não compartilhados não são representados. Essa maneira de representar é conhecida como fórmula estrutural.
Após as explicações peça para que os alunos representem as moléculas de hidrogênio (H2), enxofre (S2) e nitrogênio (N2) utilizando a representação eletrônica de Lewis e a formula estrutural, indicando os pares de elétrons livres e compartilhados quando for o caso.
Figura 4 – Fórmula estrutura para a molécula de água.
Fonte: elaborada pelo autor
Aula 03:
Leve os alunos para o laboratório de informática da escola. Mantenha os alunos nos mesmos grupos. Distribua os grupos nos computadores disponíveis. Feito isso, peça para que os alunos pesquisem na internet sobre ligações covalentes. Eles deverão pesquisar preferencialmente no site: http://www.fisica.net/quimica/resumo3.htm.
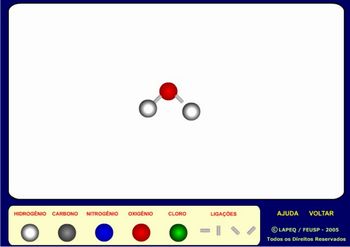
Em seguida, os alunos deverão fazer um resumo das informações das aulas e das informações pesquisadas. Esse resumo deverá ser entregue para o professor, apenas um por grupo.Após essa atividade, peça para que os alunos abram o recurso educacional abaixo. Com esse recurso os alunos deverão construir a fórmula estrutural de algumas moléculas.
Figura 5 – Fórmula estrutura para a molécula de água.
Construtor de Moléculas
http://portaldoprofessor.mec.gov.br/fichaTecnica.html?id=11712
Os alunos deverão representar as moléculas exemplificadas na aula e outras que você, professor, julgar conveniente.
Se a escola não possuir laboratório de informática, proponha para os alunos a atividade a seguir:
1 – Utilize a representação de Lewis e a fórmula estrutural para representar as moléculas abaixo, indicando os pares de elétrons livre e pares de elétrons compartilhados quando for o caso:
a) H2O b) S2 c) Cl2 d) N2 e) SO2
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Construtor de moléculas | Animação/simulação |
Recursos Complementares
- Artigo da Revista Química Nova na Escola: Ligações Químicas: http://qnesc.sbq.org.br/online/cadernos/04/ligacoes.pdf
- Site sobre Ligações Covalentes: http://www.cienciadosmateriais.org/index.php?acao=exibir&cap=2&top=32
Avaliação
Avalie a participação dos alunos ao longo das duas aulas e as atividades propostas ao longo da sistematização. Proponha também uma pesquisa sobre as características e aplicações das substâncias covalentes.
Quatro estrelas 4 classificações
- Cinco estrelas 3/4 - 75%
- Quatro estrelas 1/4 - 25%
- Três estrelas 0/4 - 0%
- Duas estrelas 0/4 - 0%
- Uma estrela 0/4 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
lkelly MirandA, Unifei , Minas Gerais - disse:
lkmiranda@gmail.com27/04/2014
Cinco estrelasExcelente!
-
Marçal, UFPB , Paraíba - disse:
marcalqp@hotmail.com06/12/2012
Quatro estrelasOtima aula !
-
Otavio, Escola , Pernambuco - disse:
otaviocreu2008@hotmail.com03/10/2012
Cinco estrelasmuitoo Booua Aula. Parabeens !
-
IVANICE CERVELIN FLOR, Particular , Santa Catarina - disse:
niceflor@gmail.com04/07/2012
Cinco estrelasParabéns! Gostei muito da dica de fazer a representação das ligações covalentes em cartolinas.
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus








 Construtor de moléculas
Construtor de moléculas