23/05/2010
Marco G. B. Burlamaqui
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
| Educação de Jovens e Adultos - 2º ciclo | Ciências Naturais | Terra como espaço para a vida |
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
O que o aluno poderá aprender com esta aula
- Identificar as propriedades físicas e químicas dos metais;
- Conceituar o modelo da ligação metálica;
- Relacionar as propriedades dos metais com o modelo da ligação metálica;
- Identificar as principais aplicações dos metais na sociedade.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
- Ligação iônica;
- Representação das ligações iônicas;
- Ligação covalente;
- Identificação da quantidade de elétrons na camada de valência através da distribuição eletrônica.
Estratégias e recursos da aula
Professor, leve para a sala de aula alguns metais: cobre, alumínio, ferro, zinco e outros. Leve também imãs. Providencie os materiais necessários para a confecção do modelo da ligação metálica: cartolinas, bolinhas de isopor, palitos para picolé e caixa de lápis de cor. Providencie também os materiais necessários para a execução do experimento descrito na Aula 3.
Aula 1:
Professor, inicie a aula pedindo para que os alunos indiquem alguns metais que eles conhecem, os alunos indicarão vários tipos de metais, principalmente o ferro, pois é o que eles têm mais contato. Em seguida apresente para eles os metais que você levou para a sala. Peça para que os alunos descrevam algumas características dos metais apresentados: cor, peso em relação a outro metal, atração eletromagnética (eles deverão utilizar os imãs) e outras características que os alunos acharem importantes. Depois que cada aluno relacionar as características dos metais no seu caderno, informe que os metais possuem algumas propriedades importantes para o uso na sociedade.
Figura 1 – Exemplos da utilização dos metais na sociedade
Fonte: http://www.metalaco.com.br/fotos/fio_cobre.jpg
http://www.riobranco.org.br/arquivos/sites2008/6_agosto/grupo4/site/images/ferro.jpg
http://static.hsw.com.br/gif/aluminio-1.jpg
Em seguida, leve os alunos para o laboratório de informática, no laboratório divida a turma em 6 grupos. Informe aos alunos que eles deverão pesquisar sobre uma propriedade física dos metais, no caso faça a seguinte divisão dos temas:
Grupo 1 – maleabilidade
Grupo 2 – ductilidade
Grupo 3 – Condutibilidade elétrica
Grupo 4 – densidade e dureza
Grupo 5 – condutibilidade térmica
Grupo 6 – cor e brilho
Cada grupo deverá pesquisar o assunto e elaborar uma maneira de apresentar as informações para os demais alunos.
Para direcionar os alunos, informe que eles deverão pesquisar preferencialmente nos sites abaixo:
http://www.arq.ufsc.br/arq5661/Metais/metais.html
http://www.infoescola.com/quimica/propriedades-dos-metais/
Sugira algumas formas de apresentação, como cartazes ou apresentação oral. Peça para que cada aluno elabore um resumo sobre a propriedade pesquisada pelo seu grupo e pelas propriedades apresentadas pelos demais grupos, esse resumo deverá ser entregue para o professor para compor a avaliação. Reserve aproximadamente 30 (trinta) minutos da aula para esta atividade.
Caso não disponha de um laboratório de informática, os alunos poderão fazer a pesquisa nos próprios livros didáticos e na biblioteca da escola. Professor, se a sua escola tiver um laboratório de química, poderá trabalhar com algumas das propriedades dos metais a partir dos experimentos a seguir:
Metal: mais frio ou mais quente
http://portaldoprofessor.mec.gov.br/fichaTecnica.html?id=13647
 Metal: mais frio ou mais quente
Metal: mais frio ou mais quente
condução de calor
http://portaldoprofessor.mec.gov.br/fichaTecnica.html?id=11095
Calor Específico
http://portaldoprofessor.mec.gov.br/fichaTecnica.html?id=11094
Após essa atividade, explique aos alunos que os metais também possuem algumas características em relação às reações químicas que podem ocorrer com outras substâncias, essas características são denominadas características químicas. Uma reação química muito característica é a corrosão (ferrugem), explique que não são todos os metais que sofrem corrosão, o ferro é um dos metais que mais se deterioram pela corrosão.
Aula 02:
Em seguida, informe aos alunos que para explicar muitas propriedades dos materiais metálicos, é necessário entender como se dá a interação entre seus átomos, denominada ligação metálica.
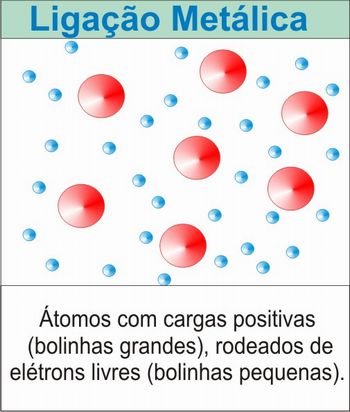
Se estiver usando o laboratório de informática, peça para que os alunos pesquisem sobre a ligação metálica, anotando palavras-chave referentes ao assunto. É provável que os alunos anotem expressões como: “mar de elétrons”, “nuvens de elétrons”. Explique aos alunos que o modelo que melhor explica a ligação metálica considera que o metal sólido é constituído por átomos com cargas positivas, rodeados de elétrons livres, que se movimentam por todo o metal. Esse modelo de ligação também explica outras propriedades macroscópicas dos metais, como por exemplo, o brilho dos metais, que de acordo com esse modelo, é resultante da oscilação dos elétrons da camada de valência do metal quando o material é iluminado. Os alunos deverão concluir a pesquisa e fazer um resumo para compor a avaliação.
Feito isso, peça para que cada grupo desenhe ou crie um modelo para a ligação metálica. Para isso, eles poderão utilizar as cartolinas, as bolas de isopor e os palitos para picolé. Depois que os alunos terminarem os seus modelos, peça para que cada grupo apresente o modelo criado para a turma, identificando as principais informações desse modelo. Reserve o restante dessa aula para que os alunos concluam essa atividade.
Figura 2 – Representação do modelo da ligação metálica
Fonte: elaborada pelo autor
Aula 3:
Professor, informe aos alunos que será feito um experimento demonstrativo sobre as ligas metálicas. Para isso, siga o roteiro experimental abaixo:
Roteiro Experimental
Materiais:
• moedas de 5 centavos de real (cobre);
• 25mL de solução de hidróxido de sódio (NaOH) 3 mol/L;
• 25g de zinco em pó;
• um béquer de 150mL ou um copo que suporte calor;
• fonte de calor (chapa elétrica, fogão, microondas, etc);
• maçarico ou lamparina;
• uma pinça;
• uma espátula.
Procedimentos:
1 – Coloque a solução de hidróxido de sódio dentro do béquer e em seguida adicione zinco em pó dentro do béquer com a solução.
2 – Aqueça a mistura até perto da ebulição. A solução tomará um aspecto limpo, e o zinco ficará totalmente precipitado no fundo.Tome muito cuidado para não respirar os vapores da solução e para evitar respingos. A solução de hidróxido de sódio é corrosiva.
3 – Nesse momento, coloque a moeda dentro da solução com o auxílio da pinça, e certifíque-se de que a moeda esteja sobre o zinco.OBS: a moeda deve estar limpa e sem oxidação. Você pode limpar a moeda usando uma solução ácida, como por exemplo, de vinagre ou suco de limão.
4 – Depois de um tempo, a moeda inicialmente com a cor característica do cobre, passa a assumir uma coloração prateada. Aproximadamente dois minutos depois a moeda estará completamente cor de prata.
5 – Retire a moeda com auxílio da pinça. Lave com água corrente, a moeda estará prateada.
6 – Acenda o maçarico, segure a moeda com a pinça e leve-a diretamente à chama por alguns segundos e veja que agora a moeda está cor de ouro. Não precisa aquecer demais.
Esfrie a moeda num copo com água ou na pia antes de manuseá-la.
Se desejar, repita o procedimento com mais moedas para entregar para os alunos.
Figura 3 – Resultado do experimento
Fonte: http://pontociencia.org.br/imgdb/experimentos/38571ec782993756dc93d269d9348ee2.jpg. Acessado em 12 de maio de 2010.
Experimento adaptado do site: http://pontociencia.org.br/experimentos-interna.php?experimento=154&COBRE+PRATA+E+OURO#top. Acessado em 12 de maio de 2010.
Para esse experimento será preciso aproximadamente 45 minutos, pois ele será repetido algumas vezes para que sejam produzidas várias moedas.
Para sistematizar a aula e complementar o conteúdo, os alunos deverão pesquisar sobre ligas metálicas e as suas principais aplicações na sociedade. Os alunos deverão identificar a composição das principais ligas: latão, bronze e aço. Essa pesquisa deverá ser entregue posteriormente para o professor. Também deverão fazer um relatório do experimento da aula 3, para consolidar o conteúdo sobre ligas metálicas.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Metal: mais frio ou mais quente | Experimento prático |
| condução de calor | Experimento prático |
| Calor específico | Experimento prático |
| Metal: mais frio ou mais quente | Experimento prático |
| condução de calor | Experimento prático |
| Calor específico | Experimento prático |
Recursos Complementares
Artigo da Revista Química Nova na Escola: Ligações Químicas:
http://qnesc.sbq.org.br/online/cadernos/04/ligacoes.pdf
Artigo sobre as Ligações Metálicas:
http://www.foco.fae.ufmg.br/viienpec/index.php/enpec/viienpec/paper/view/246/220
Avaliação
A avaliação deverá ser composta pela participação dos alunos e pelas atividades entregues ao longo das aulas. Professor, avalie também as atividades propostas na parte de sistematização da aula.
Quatro estrelas 3 classificações
- Cinco estrelas 2/3 - 66.67%
- Quatro estrelas 0/3 - 0%
- Três estrelas 1/3 - 33.33%
- Duas estrelas 0/3 - 0%
- Uma estrela 0/3 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Oscar, PXT , Goiás - disse:
Osc.quim@gmail.com27/08/2014
Três estrelasgostei do modelo ele representa as moleculas dos metais interagindo
-
maiane , uesb , Bahia - disse:
mayanne_bp@hotmail.com04/11/2012
Cinco estrelasbem planejado....
-
cristiane, ufpa , Pará - disse:
cristianemacapuna@hotmail.com22/03/2012
Cinco estrelasgostei muitissimo me ajudou muiiito....
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus