21/02/2011
Mary Grace Martins (validadora)
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
O que o aluno poderá aprender com esta aula
Após esta aula o alunos será capaz de identificar e caracterizar os fenômenos de:
- Oxidação
- Redução
- Agente oxidante
- Agente redutor
- A conservação do número de elétrons ganhos e perdidos em uma reação de oxi-redução.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
- Regras para determinação do número de oxidação (NOX) de espécies químicas.
- Reações inorgânicas (síntese, análise, simples e dupla troca).
- Balanceamento de equações.
Estratégias e recursos da aula
Neste experimento será possível realizar uma introdução ao estudo das reações de oxiredução e começar a conceituar oxidação, redução, agentes oxidante e redutor com materiais alternativos e de baixo custo. Trata-se de uma demonstração experimental feita pelo professor. Esta demonstração pode ser feita no laboratório ou em sala de aula mesmo, pois não requer muitos equipamentos ou vidrarias. Para realizar o experimento introdutório a aula, devemos ter disponível:
- Um pedaço de palha de aço
- Água sanitária
- Tubo de ensaio
Fonte: images.google.com
1ª Etapa: Experimento e análise do resultado (10 min)
Com a ajuda de um bastão de vidro, adicione um pequeno pedaço da palha de aço e a movimente até o fundo do tubo de ensaio, procurando deixar os fios desambaraçados. Chame a atenção dos alunos para o aspecto a palha de aço neste momento. Após, adicione com cuidado a água sanitária até 2/3 do tubo. Aguarde aproximadamente dez minutos até observar a formação de sólidos de cor marrom formando-se nos fios da palha de aço.
Enquanto espera a reação ocorrer, discuta com os alunos, enquanto o tubo de ensaio passa entre eles, sobre as hipóteses do que está ocorrendo. Chame a atenção deles para que olhem para a formação de 'algo' de cor marrom. Provavelmente neste momento eles falarão da ferrugem sendo formada, devido ao aspecto familiar desta reação. Caso contrário, é possível uma passeio rápido pela escola a procura de materiais ferrosos oxidados, a fim de comparar com o aspecto do sólido marrom formado. A fim de relacionar o experimento com a formalização química do fenômeno, lance a pergunta: "O que realmente está acontecendo dentro do tubo de ensaio?" Reproduza no quatro das ideias que os alunos laçarem.
2ª Etapa: Formalizando o que se observou no experimento e discussão (40 min)
Inicie a formalização com considerações a respeito do que se misturou no tudo de ensaio. Sabe-se que a palha de aço é praticamente ferro [Fe(s)] e a água sanitária uma solução de hipoclorito de sódio [NaClO(aq)]. Então, com a ajuda dos alunos, pode-se montar a equação para a reação química:
Fe(s) + NaClO(aq) --> Fe2O3(s) + NaCl(aq)
Após, com ajuda dos alunos, pode-se realizar o balançeamento da equação, obtendo:
2 Fe(s) + 3 NaClO(aq) --> Fe2O3(s) + 3 NaCl(aq)
Neste momento, com a equação pronta e balanceada, peça aos alunos que determinem os NOX de cada elemento presente na equação, separando os elementos que mudam seu NOX dos que não mudam o NOX. Enquanto eles observam o experimento no tubo, recolha esta atividade e observe se todos separaram os elementos conforme variação do NOX de forma adequada.
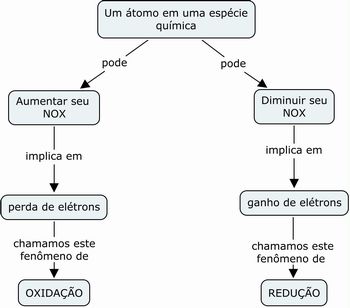
A partir deste momento, é possível formalizar os conceitos de oxidação (perda de elétrons, aumento do nox) e redução (ganho de elétrons, diminuição do NOX). Após a formalização dos conceitos, peça aos alunos para criarem um mapa conceitual que relacione os seguintes conceitos:
- oxidação
- redução
- nox
- elétrons
Como sugestão de construção, segue um mapa conceitual que cumpre com os critérios acima indicados. Os alunos podem ir até ao laboratório de informática para construir seus mapas conceituais. Para maiores informações sobre mapas conceituais e como fazê-los no computador, veja maiores informações na seção "Recursos complementares".
Após a construção dos mapas, recolha e veja se estão corretos. Devolva os mapas e em seguida formalize os conceitos de agente oxidante e agente redutor. Peça aos alunos para incluir este dois conceitos no mapa devolvido. Recolha novamente e analise se eles foram incluídos de forma correta.
Outro pequeno experimento possível dentro da mesma temática é pegar um pedaço de pano colorido e pingar algumas gotas de água sanitária. Se este ficar branco é por causa do hipoclorito de sódio, um agente oxidante forte que, em contato com os pigmentos do tecido, os oxida fazendo com que eles percam as cores originais.
Como sugestão de atividade extra-classe, divida os alunos em grupos de quatro integrantes e peça aos alunos realizarem este mesmo experimento em casa. Peça a eles que filmem com uma câmera digital durante uns 20 minutos o tubo de ensaio com a palha de aço sendo oxidada pela água sanitária. Após, peça a eles que transformem o video para que ele passe de forma acelerada, a fim de evidenciar a formação da oxidação do ferro. Peça a eles postarem no youtube. Para isto, indique o seguinte tutorial:
http://www.google.com/support/youtube/bin/topic.py?hl=br&topic=16560
Uma aula posterior deve ser dedicada a passagem dos videos produzidos para a socialização entre os alunos.
Recursos Complementares
Para a construção de mapas conceituais, pode-se utilizar o programa Cmap Tools (http://cmap.ihmc.us)
Para maiores informações a respeito de mapas conceituais e uma aprendizagem significativa, veja esta referência: http://www2.iq.usp.br/docente/famaxim/disciplina/integrada/mapasport-Moreira.pdf
Avaliação
A avaliação desta atividade se dá na medida em que os alunos irão interagir na construção do conhecimento, sob os questionamentos constantes a cada etapa. É sugerido que eles façam a análise das reações abaixo e indique, além de quais são de oxiredução, também que está se oxidante, quem está se reduzindo, quem são os agentes oxidantes e redutores da reação:
a) 3 H2SO4 + Ca3(PO4)2 --> 3 CaSO4 + 2 H3PO4
b) 6 H2O + 6 CO2 --> C6H12O6 + 6 O2
c) Zn + HCl --> ZnCl2 + H2
Caso seja utilizada a sugestão dos videos, marcar uma aula para todos os alunos assistirem os videos uns dos outros. Pode-se avaliar a qualidade da imagem e organização do vídeo. Para finalizar, permita que os grupos façam considerações sobre os mapas conceituais dos outros grupos, assim possibilitando o mútuo aprendizado.
Cinco estrelas 6 classificações
- Cinco estrelas 6/6 - 100%
- Quatro estrelas 0/6 - 0%
- Três estrelas 0/6 - 0%
- Duas estrelas 0/6 - 0%
- Uma estrela 0/6 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Crislan Neves, Escola Estadual Dr. Aristides Maltez , Bahia - disse:
crislanneves@gmail.com05/11/2015
Cinco estrelasAula muito bem explicada facilitando o aprendizado
-
wanderson, etc getulio vargas , São Paulo - disse:
wandersonnunes38@hotmail.com01/05/2015
Cinco estrelasmuito bom
-
Diego Mascarinho, no , Rondônia - disse:
dyegosantosmascarinho@hotmail.com26/05/2014
Cinco estrelasotima esperiencia para se fazer :)
-
Ledeiser Jorge Lara, SEEDF , Distrito Federal - disse:
ledeiser@hotmail.com19/09/2011
Cinco estrelasExcelente! Símples e fácil de ser aplicado com o mínimo de recursos. Didática excelente. Parabéns
-
Rafaella, UNIB , São Paulo - disse:
rafaellagrenfell@yahoo.com.br06/06/2011
Cinco estrelasBem simples e útil em sala de aula.
-
RENATO FERNANDO CERINO, particular , São Paulo - disse:
renato.cerino@gmail.com24/04/2011
Cinco estrelasParabéns pela didática.
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus