21/02/2011
Mary Grace Martins (validadora)
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
O que o aluno poderá aprender com esta aula
Prever o comportamento ácido/básico e neutro de sais inorgânicos quando estes estiverem dissolvidos em água. Estabelecer uma relação entre a fórmula e o caráter ácido/básico e neutro de um sal.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Saber dar nome de ácidos, bases e sais a partir da fórmula e vice-versa. Saber prever o caráter forte ou fraco de ácidos (hidrácidos e oxiácidos) e bases.
Estratégias e recursos da aula
Após a aula "Observando a hidrólise salina com experimentos" (http://portaldoprofessor.mec.gov.br/verAula.html?aula=18861) é possivel perceber que o comportamento dos sais em água nem sempre é neutro (pode ser, mas não necessariamente). Nesta aula teremos a formalização a respeito da hidrólise, o que permitirá o aluno fazer previsões do comportamento ácido/básico/neutro de sais em água e, em situações problemas, tomar decisões a respeito da utilização de um ou outro sal.
Primeira Etapa: revisão de pré-requisitos (15 min)
Você professor(a) pode começar sua atividade de previsão do caráter ácido, básico e neutro dos sais levando os alunos até o laboratório de informática e fazendo uma revisão sobre reações entre ácidos e bases, propondo que os alunos respondam o seguinte QUIZ disponivel abaixo:
Separe os alunos em duplas. Peça a eles que tentem responder aos questionamentos consultando o livro didático ou a Internet. Acompanhe eles durante a atividade, intervindo com esclarecimentos se necessário. A seguir estão alguns endereços que você pode passar aos alunos para pesquisa:
http://www.fisica.net/quimica/resumo12.htm
http://www.moderna.com.br/pnlem2009mg/quimica/canto/volumes/pdfs/a1_12.pdf
http://www.klickeducacao.com.br/conteudo/pagina/0,6313,POR-1048-7355-,00.html
Dependendo da desenvoltura dos alunos na atividade, você pode ir até o quadro e fazer uma pequena revisão sobre o tema ou então projetar o plano de aula a seguir no datashow e explicar o conteúdo:
http://educacao.uol.com.br/planos-aula/ult3907u54.jhtm
Sem a plena compreensão deste temas de pré-requitos, não é possível formalizar o entendimento da hidrólise salina.
Segunda etapa: exposição sobre hidrólise salina (25 min)
Após a realização da atividade no laboratório de informática, neste mesmo laboratório o professor pode abordar a hidrólise salina. Trataremos aqui dos sais proveniente da neutralização total entre um ácido e uma base. Assim, deseja-se criar no aluno uma linha de pensamento a respeito de como identificar um sal com potencialidades ácidas, básicas ou neutras. Com este objetivo, podemos expor a seguinte análise.
A exposição disponivel em formato apresentação do PowerPoint em: www.quimica.net/emiliano/ensinomedio/teoria_hidrolise-salina.ppt
(edite os slides acrescentando animações, ao seu critério, a fim de tornar as equações e frases dinâmicas).
Após a explanação, então, é possível fazer uma previsão sobre o comportamento ácido, básico ou neutro dos sais. Mas, para que me serve isto? Este é o tema da aula "utilizando os conhecimentos sobre hidrólise salina em situações problemas" (http://portaldoprofessor.mec.gov.br/verAula.html?aula=19499). Neste momento você pode comentar sobre a correção do pH do solo, da acidez estomacal, dentre outras aplicações. Mas só comentar, antecipando o que será detalhado na aula referida.
A fim de verificar o que foi compreendido e o que precisa ser esclarecido, peça aos alunos que determinem o caráter ácido/básico/neutro dos seguintes sais:
a) KNO3. b) AlCl3. c) NH4Cl. d) NaCl. e) Na2CO3.
Sorteie alguns alunos para, a frente da turma, explicar sua linha de raciocício que levou a determinar o caráter do sal. Com esta estratégia, além de você professor reconhecer eventuais imprecisões no pensar dos alunos, os outros colegas poderão aprender sobre o assunto ouvindo seus colegas falarem a respeito.
Terceira etapa: sistematizando os conceitos (10 min)
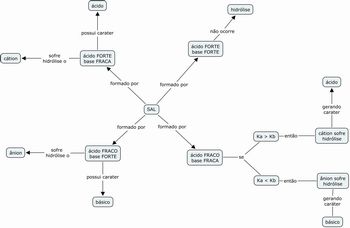
O mapa conceitual é uma ferramenta, além de poderosa, muito versátil. O mapa conceitual abaixo resume as regras para determinar o caráter ácido, básico ou neutro de um sal e serve como referência para o professor.
Cabe ao professor(a) determinar se:
a) monta o mapa conceitual com a ajuda dos alunos no quadro, questionando e tentando selecionar as melhores idéias de montagem;
b) pede para os alunos montarem os seus mapas conceituais, recolhe e aponta possíveis erros de relação, devolve e recolhe novamente até ficarem adequados;
c) organiza duplas ou trios de alunos para que, nestes pequenos grupos, eles montem um mapa conceitual sobre as regras vistas acima.
De qualquer forma, o professor conseguirá identificar claramente possíveis erros conceituais sobre hidrólise e verificar se houve aprendizagem sobre este assunto que envolve o relacionamento de vários conceitos da química. Ao final, na seção de "avalição" desta aula, os alunos serão apresentados a uma situação problema em que é possível verificar se os alunos estão com um modelo metal correto a cerca do comportamento ácido/básico/neutro dos sais em água e conseguem tomar uma decisão diante de uma situação problema contextualizada.
Sobre a construção dos mapas, estes podem ser feitos com programas específicos de mapas conceituais, conforme é indicado na seção "Recursos Complementares" desta aula. Se achar conveniente, leve os alunos até o laboratório de informática para que eles façam o mapa conceitual sobre hidrólise salina.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Reações ácido/base | Software Educacional |
Recursos Complementares
Veja as aulas on-line disponíveis no youtube:
> http://www.youtube.com/watch?v=LhQUZDd48TM
> http://www.youtube.com/watch?v=gWWyM0B2tV8
Para a construção dos mapas conceituais, é possível utilizar o programa Cmap Tools (http://cmap.ihmc.us/) Também é indicado um pequeno tutorial (http://penta2.ufrgs.br/edutools/tutcmaps/tutindicecmap.htm) do programa.
Avaliação
A avaliação dos alunos deve ser feita a cada etapa concluída por eles. Pode-se observar e avaliar o envolvimento dos alunos na etapa da revisão dos pré-requisitos e a desenvoltura na resolução das atividades. Como sugestão, determine um tempo máximo para a resolução das questões e observe o número de questões respondidas corretamente. Após a exposição dos conceitos de hidrólise em cada caso, na terceira etapa, será oportunizado um momento para o aluno sistematizar os conceitos na forma de mapa conceitual. Este mapa conceitual pode fazer parte da avaliação do aluno. Pode-se relacionar os critérios de avaliação em relação a clareza e correção das relações, criatividade e abrangência do mapa.
O sucesso desta aula está muito relacionado ao empenho dos alunos. Por isto, neste caso, uma auto-avaliação também pode ser utilizada a fim de contribuir para a nota final do aluno. Peça a cada aluno mandar um e-mail com uma nota de zero a dez com justificativa para você. Por fim, com caráter de desafio, após o desenvolvimento da aula, proponha aos alunos a situação problema descrita abaixo (peça o aluno para propor e justificar suas escolhas, conforme as respostas esperadas abaixo)
Uma das principais causas de morte na faixa etária de 15 a 35 anos é a ingestão de drogas em doses elevadas. Em situações de emergência, a informação correta sobre o tipo de droga ingerida é fundamental para salvar vidas. No caso de compostos ácidos como fenobarbital (Gardenal) e salicilato (Aspirina), a eliminação é facilitada pela alcalinização da urina (caso I). Para anfetaminas (arrebite), recomenda-se a acidificação da urina (caso II). Escolha a melhor indicação de sal para o tratamento em cada caso:
Caso I :______________ Caso II: ______________
Possibilidades: NaF, NaHCO3, KNO3, NH4Cl, NH4NO3, KCl, NaCl.
Respostas esperadas:
No caso I temos que alcalinizar a urina, ou seja, adicionar um sal que tenha carater básico. Este deverá ser formado por um cátion de base forte e um ânion de ácido fraco. Neste caso, os possíveis sais dentre os indicados são NaF e NaHCO3.
No caso II temas que acidificar a urina, ou seja, adicionar um sal que tenha caráter ácido. Este deverá ser formado por um cátion de base fraca e um ânion de ácido forte. Dentre as opções, temos: NH4Cl como única alternativa. KCl e NaCl, juntamente com KNO3 são sais neutros.
Sem estrelas 0 classificações
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncie opiniões ou materiais indevidos!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus