20/06/2010
Suelen Fernanda Machado
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Língua Portuguesa | Gêneros discursivos e textuais: narrativo, argumentativo, descritivo, injuntivo, dialogal |
| Ensino Médio | Língua Portuguesa | Produção, leitura, análise e reflexão sobre linguagens |
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
O que o aluno poderá aprender com esta aula
Nesta aula os alunos podem aprender sobre solubilidade, soluções iônicas e moleculares, soluções em concentrações definidas e quantidade de soluto em uma solução.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
É necessário que os alunos saibam os conteúdos: misturas, partículas, moléculas, cálculo da massa molar das substâncias e medida de concentrações.
Estratégias e recursos da aula
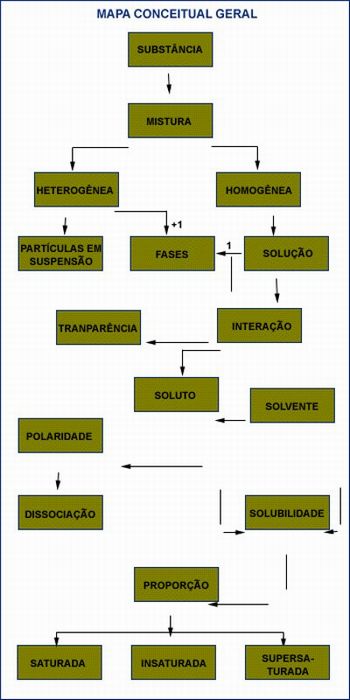
Solicite aos alunos que ordenem as palavras em destaque no caderno de forma a representar o processo químico e classificação das misturas.
Palavras: solução, mistura homogênea, substâncias, fases, saturadas, mistura heterogênea, partículas em suspensão, dissociação, polaridade, solubilidade, transparência, supersaturada, proporção, solvente, insaturada, interação e soluto.
Esta atividade permite levantar que conhecimentos trazem os alunos sobre mistura e solução. Ao finalizarem, utilize o quadro e construa juntamente com eles o mapa conceitual para que possam comparar com aquele que contruíram no caderno. Professor você pode acessar o link abaixo para se orientar sobre como desenvolver esta ação.
Link: http://www.moderna.com.br/moderna/didaticos/em/artigos/2004/0027.htm
Pergunte aos alunos se o café com leite é uma mistura. Provavelmente, digam que sim. Retome o conceito de mistura homogênea e heterogênea.
Explique o que é solução a partir destes exemplos: xarope medicinal (solução saturada), urina (solução de diversos sais e toxinas), refrigerante artificial, tintas à base de água e a óleo. Peça que apresentem outros exemplos, que anotem as perguntas e respostas no caderno pois os questionamentos podem ser objetos da avaliação e além disso um indicativo de que os conteúdos foram apropriados. Faça intervenções se necessário para corrigir possíveis equívocos.
Na sala de aula, utilize o quadro e peça aos alunos que anotem no caderno o seguinte: Solução é uma mistura homogênea constituída por duas ou mais substâncias numa só fase que são formadas por um solvente (dispersante, em maior quantidade) e um ou mais solutos (disperso em menor quantidade). Destacamos alguns exemplos de soluções com suas fórmulas e utilidade no cotidicano.
- Ácido sulfúrico: Fórmula: H2SO4(aq) Utilidade: bateria de automóveis
- Álcool hidratado: Fórmula: C2H2OH.H2O Utilidade: bebidas, combustívelm limpeza do lar, etc.
- Formol: Fórmula: HCHO - 40% Utilidade: conservação de cadáveres
- Vinagre: (ácido acético) Fórmula: CH3COOH - 4% Utilidade: tempero de alimentos, conservante
- Salmoura: Fórmula: NaCl(aq) Utilidade: conservação, tempero de alimentos
As soluções são classificadas de acordo com o seu estado de agregação; a proporção entre soluto e solvente; a natureza do soluto e solubilidade.
No estado de agregação, as soluções são encontradas em três fases:
- sólida - ouro 18 quilates; ligas metálicas de bronze (cobre e estanho); latão (cobre e zinco).
- líquida - água do mar constituída principalmente de cloreto de sódio (NaCl), soro caseiro, refrigerantes, etc
- gasosa – ar atmosférico
Quanto a natureza das partículas dispersas as soluções podem ser iônicas e moleculares.
Soluções iônicas ou eletrolíticas: são partículas dispersas que se encontram na forma de íons e possuem a capacidade de conduzir corrente elétrica. Explique no quadro a dissociação iônica da solução aquosa do NaCl. Peça aos alunos que observem os íons formados na reação do cloreto de sódio.
Na + Cl → Na+ + Cl-
Soluções Moleculares: as partículas dispersas (soluto) são moléculas, ou seja, o soluto é uma substância molecular. Não conduzem corrente elétrica. Exemplo: água e açucar.
Após as explicações, no laboratório de informática solicite aos alunos que se organizem em equipe formada por 4 pessoas e acessem a animação “Quem apagou a luz?” afim de que compreendam o conceito de soluções.
Roteiro
- acessar o recurso;
- ler os conceitos de soluções, soluto, solvente, solução molecular e solução iônica;
- clicar nos frascos e testar as soluções;
- rever os conceitos de ácido, sais e bases.
Atividade 1
Organize os alunos em equipes de 4 pessoas. Solicite as equipes que acessem o recurso para que aprendam a utilizar as diferentes formas de expressão da concentração de uma solução.
Link: http://objetoseducacionais2.mec.gov.br/handle/mec/867
Obs: O roteiro para desenvolver a atividade está disponível no próprio recurso.
Link: http://www.cdcc.usp.br/exper/medio/quimica/4solucaog_1.pdf
Organize os alunos em grupos de 5 pessoas, solicite que leiam o texto, sigam o roteiro e desenvolvam o experimento. A medida em que desenvolvem a atividade devem observar, fazer anotações e elaborar o relatório final. Para responder aos questionamentos e elaborar o relatório os alunos podem seguir o modelo disponível no link abaixo.
Link: www.sitedaescola.com/aulas_inovadoras/marco_amaral/Relat%f3rio.doc.
Após concluir os trabalhos devem publicá-lo em um blog que pode ser criado a partir do link: www.blogger.com/start
Atividade 2 - Construindo o mapa conceitual das soluções.
Professor, acesse o link: http://www.moderna.com.br/moderna/didaticos/em/artigos/2004/0027.htm, faça uma leitura do texto para saber de que maneira orientar os alunos a construirem um mapa conceitual. Esta atividade tem como objetivo ampliar o campo conceitual dos alunos, levando-os a sistematizarem de forma mais lógica e abrangente o conceito científico de soluções.
Atividade 3 (extra classe) - Desenvolvendo o senso de aluno investigador e pesquisador
Professor, para desenvolver esta atividade é conveniente a colaboração do professor da Língua Portuguesa pois, desenvolver a análise crítica pressupõe um conhecimento mais elaborado. Ao desenvolver esta atividade tem-se como prioridade incentivar os alunos a se envolverem e motivá-los para que se tornem pesquisadores da área.
Desta maneira, oriente os alunos que façam a leitura do texto "Como os estudantes concebem a formação de soluções" e produzam uma resenha crítica a partir do roteiro a seguir: leitura do texto, observação e análise acerca do que os estudantes entendem por solução, como diferenciam a dissolução do sal e do açúcar na água. Por fim, responder porque ao dissolver certa substância em outra, o volume final do sistema não é aditivo.
Link: http://qnesc.sbq.org.br/online/qnesc03/aluno.pdf
Interdisciplinaridade
Lingua Portuguesa: o professor pode colaborar orientando os alunos como desenvolver a análise crítica do texto disponível na atividade 3.
Os alunos podem desenvolver uma pesquisa acerca da concentração máxima de sal ou açúcar na fase aquosa de produtos como: leite evaporado; massa de tomate; carnes curadas; queijo Gouda; pão; queijo processado; salsichas cozidas; carnes e peixes levemente salgados. Na sequencia, elaborar cartazes e tornar disponível no espaço escolar e ainda, organizar palestras e apresentar a comunidade escolar visando melhorar a qualidade de vida das pessoas.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Quem apagou a luz? | Animação/simulação |
Recursos Complementares
Vídeos
Os vídeos apresentam informações que tratam do conceito de solubilidade, coeficiente de solubilidade, concentração de soluções sempre a partir de situações reais.
Link: http://www.youtube.com/watch?v=cXNb9o8bMtk&feature=related
Link: http://www.youtube.com/watch?v=gPwVdhRv1Os&feature=related
Vídeo do Prof. Toid que tratam das soluções.
Link: http://www.youtube.com/watch?v=yYagFIwCLhg&feature=related
Sitios
No link a seguir se encontra o conceito de Solução.
Link: http://pt.wikipedia.org/wiki/Solu%C3%A7%C3%A3o
Para saber sobre solução iônica acesse o link: http://pt.wikipedia.org/wiki/Eletr%C3%B3lito
Site que apresenta conteúdo sobre mistura, dispersão e solução.
Link: http://www.virtualquimica.hpg.com.br/misturas.htm
No link a seguir pode-se saber sobre Solução.
Link: http://www.setrem.com.br/ti/trabalhos/quimica/solucoes.htm
Link: http://www.mundoeducacao.com.br/quimica/classificacao-das-solucoes.htm
Link: http://portal.mec.gov.br/seb/arquivos/pdf/EnsMed/expensquim_vol4.pdf
Livros
Carvalho, Geraldo Camargo de. Química moderna 1.Scipione. São Paulo: 1995.
Sardella e Mateus. Curso de Química: físico-química. Ática. São Paulo: 1992
Reis, Martha Química Integral.Vol. Único. FTD. 1993. p. 385
Avaliação
O professor poderá avaliar se utilizando dos modelos de avaliações diagnóstica e formativa bem como seguir os critérios que sugerimos:
a) Participação ativa na realização das atividades no computador discussões desenvolvidas na aula pela entrega das respostas das questões de sistematização.
b) Organização dos pressupostos teóricos que norteiam o conhecimento sistematizado dos conteúdos ao participar e tomar decisões criticamente ao analisarem e relataram as informações dos vídeos;
c) Compreensão dos processos químicos relacionados com a vida cotidiana ao analisarem as informações presentes nas bulas de remédios;
d) Entendimento das implicações sociais decorrentes das aplicações tecnológicas na elaboração de produtos e substências químicas;
e) Compreensão sobre o papel de estudantes autônomos que desejam se tornar investigadores e pesquisadores;
d) Facilidade em atuar conforme a natureza do processo de construção do conhecimento científico a partir da produção dos textos e relatos;
e) Percepção sobre o papel da química perante o contexto social do qual fazem parte ao proporem a Prática Social Final dos conteúdos.
Cinco estrelas 1 classificações
- Cinco estrelas 1/1 - 100%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
silvana alves, Escola estadual NM-9 , Pernambuco - disse:
silvanabiologa@hotmail.com15/02/2011
Cinco estrelasexcelente o conteúdo....gostaria de saber como adquirir urgentemente uns videos , sobre o conteúdo dado na quimica do ensino médio...obrigado...
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus





 Quem apagou a luz?
Quem apagou a luz?