21/02/2011
Mary Grace Martins (validadora)
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
O que o aluno poderá aprender com esta aula
O aluno aprenderá nesta aula a interpretar os fenômenos de condução de corrente elétrica em meio aquoso, realizando uma construção mental do modelo de íon a partir de uma representação a nível atômico/molecular.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Estrutura atômica, cátions, ânions, eletrosfera e distribuição eletrônica (diagrama das diagonais). Ligações químicas interatômicas (iônica, covalente e metálica) e intermoleculares (dipolo-dipolo, ligações de hidrogênio).
Estratégias e recursos da aula
Após a aula "Experimento para determinação de eletrólitos e não eletrólitos" (http://portaldoprofessor.mec.gov.br/verAula.html?aula=19742), surge a necessidade, agora, de uma explicação a partir dos modelos sobre a interação de substâncias com a água que dará suporte a introdução do contéudo 'funções inorgânicas'. Esta atividade é de fundamental importância para introdução das funções inorgânicas, pois estas baseiam-se essencialmente em fenômenos de ionização e dissociação iônica.
Inicialmente, leve os alunos ao laboratório de informática. Separe dois alunos por computador. Inicialmente, peça aos alunos que observem as duas animações que representam a dissolução, a nível microscópico, de NaCl (sal de cozinha) e C12H22O11 (açúcar).
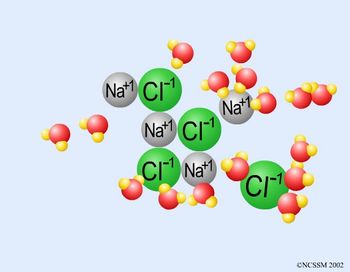
> Animação A: Dissolução do NaCl em água
http://www.quimica.net/emiliano/dissolucao-nacl.html
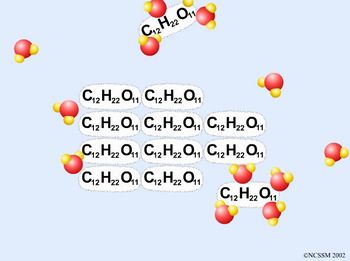
Animação B: Dissolução de C12H22O11 em água
http://www.quimica.net/emiliano/dissolucao-acucar.html
Solicite que redijam um parágrafo descrevendo o que estão vendo. Então, peça que alguns alunos leiam e faça suas considerações. A fim de verificar a compreensão de todos, solicite aos alunos para elaborar respostas para o seguinte questionário:
1) Animações A e B: A partir das fórmulas das substâncias, é possível prever o tipo de ligação a partir dos átomos que contituem as substâncias. Diga qual é o tipo de ligação existente no NaCl e no açúcar.
No caso do NaCl, trata-se de uma ligação iônica, ao passo que no açúcar, como C, O e H são não metais, este composto possui apenas ligações covalentes.
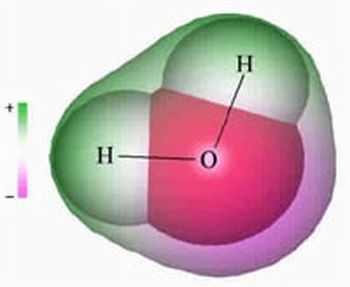
2) Animação A: Por que as moléculas de água estão orientadas com os oxigênios grudados no íon cloro e com os hidrogênios grudados no íon sódio? Explique utilizando como referencial esta representação da molécula de água:
fonte: http://www.quimica.net/emiliano
Conforme a imagem sugere, o oxigênio é o átomo que possui a carga negativa da molécula polar de água, enquanto que os hidrogênios são responsáveis pelas cargas positivas. Como o íon sódio tem carga positiva, e devido ao fato de cargas de mesmo sinal sofrerem repulsão e cargas opostas sofrerem atração, as moléculas de água ficarão orientadas com os oxigênios virados para o cátion sódio, enquanto que para o ânion cloro as moléculas ficam orientadas com os hidrogênios virados para ele.
2) Animação B: Procure na internet uma representação da fórmula estrutural da sacarose e tente explicar a partir dela, a capacidade de dissolução do açúcar em água.
Sugestões de websites:
> http://www.qmc.ufsc.br/qmcweb/artigos/forcas_intermoleculares.html
> http://hermes.ucs.br/ccet/defq/naeq/material_didatico/textos_interativos_33.htm
> http://www.qmc.ufsc.br/qmcweb/artigos/agua.html
Na estrutura molecular da sacarose (veja figura - http://www.qmc.ufsc.br/qmcweb/artigos/liquidos/sacarose.gif) temos grupos OH (hidroxilas) sujeitos a ligações de hidrogênio com a água, o que explica a dissolução da sacarose em água.
-----------------------
Após o questionário, os alunos devem acessar seguinte animação:
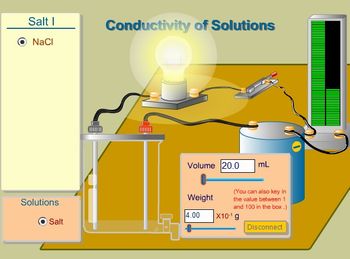
> Condutividade de soluções aquosas
http://www.quimica.net/emiliano/condutividade-solucoes.html
Peça aos alunos para fazerem os seguintes testes e anotar os resultados:
1) comparar o brilho da lâmpada de:
a) substância NaCl, volume de 20 mL e massa de 100 x 10-1 g.
b) substância NaCl, volume de 20 mL e massa de 1 x 10-1 g.
2) comparar o brilho da lâmpada de:
a) substância HCl, volume de 20 mL e massa de 100 x 10-1 g.
b) substância HCl, volume de 20 mL e massa de 1 x 10-1 g.
Espera-se que em ambos os testes, a lâmpada acenda e ela brilhará mais quanto mais da substância for adicionada. Então, problematize com a pergunta: o cloreto de sódio tem caráter iônico e em água este composto dissocia-se em íons, responsáveis pela condução de corrente pela solução. Como, então, pode haver condução de corrente em uma substãncia de caráter covalente? Solicite que cada aluno faça um parágrafo para responder a esta pergunta. Após, agrupe os alunos em trios e faça com que discutam e reformulem seus parágrafos.
É a partir desta problematização que se pode dar início ao ensino formal das funções ácido, base, sais e diferenciar o que é uma dissociação iônica que sais e bases podem sofrer (NaCl e NaOH, por exemplo) de uma ionização que os ácidos, de caráter covalente, sofrem (HCl por exemplo).
Recursos Complementares
Alguns exemplos de utilização de PowerPoint na química está disponíveis no seguinte website:
http://facweb.eths.k12.il.us/weinerj/
Avaliação
Como atividade de avaliação, além dos questionários propostos nesta aula, proponha a construção de animações no PowerPoint dos mecanismos de dissolução do cloreto de sódio e sacarose em água. Este programa tem recursos de animação que permitirão representar o mecanismo de dissolução. Proponha grupos de três alunos para fazer as animações. Estas devem dar conta dos aspectos discutidos no questionário a respeito da interação do soluto com o solvente.
Três estrelas 1 classificações
- Cinco estrelas 0/1 - 0%
- Quatro estrelas 0/1 - 0%
- Três estrelas 1/1 - 100%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Nilda Leite , E.E , Minas Gerais - disse:
lily.nilda@hotmail.com02/10/2013
Três estrelasÉ uma aula bem elaborada, ajuda o aluno a ter noção de formação de corrente elétrica pela dissociação dos íons.
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus