28/01/2011
Marco G. B. Burlamaqui
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
O que o aluno poderá aprender com esta aula
• Identificar alguns fatores que influenciam no equilíbrio químico;
• Conceituar o Princípio de Le Chatelier;
• Identificar as aplicações do Princípio de Le Chatelier;
• Constatar, através de um programa educativo, os conceitos envolvidos no Princípio de Le Chatelier.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
• Reações endotérmicas e exotérmicas;
• Equilíbrio químico.
Estratégias e recursos da aula
Tutorial do programa Le Chat 2.1
Professor, esse é um tutorial das funções do programa Le Chat 2.1 que serão utilizadas na atividade da Aula 2.
Primeiramente, baixe o programa no site: http://nautilus.fis.uc.pt/wwwqui/equilibrio/eqq_downloads/lechat21.zip. Siga com as instruções de instalação do programa. Depois de instalado, inicie o programa. Antes de utilizá-lo em sala de aula se familiarize com as suas funções.
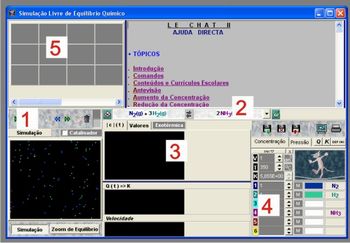
Figura 1 – informações sobre o programa
Fonte: Elaborada pelo autor
1 – Pausa, continua, avança e retrocede a simulação da reação de equilíbrio;
2 – Seleciona uma reação para a simulação;
3 – Gráfico da concentração em função do tempo;
4 – Dados da concentração dos reagentes e produtos, pode aumentar ou diminuir a concentração;
5 – Seleciona os dados simulados anteriormente.
O manual completo do programa pode ser acessado no site: http://nautilus.fis.uc.pt/softc/programas/manuais/le-chat/manual.htm
Instale o programa nos computadores do laboratório e salve um atalho na área de trabalho. Providencie os materiais necessários para a execução do experimento citado na descrição da aula. Providencie também uma máquina fotográfica digital que também permita filmar, para cada um dos grupos.
Professor, essa aula é para ser ministrada no último ano do Ensino Médio, pois vários conceitos químicos serão utilizados para atingir os objetivos propostos nessa aula.
Aula 01:
Professor, nessa aula os alunos irão constatar experimentalmente que a temperatura influencia no equilíbrio químico. Para isso, você deverá preparar a reação de equilíbrio suficiente para cada um dos grupos, e como demonstração, faça a solução de equilíbrio para que os alunos vejam os procedimentos. Já deixe preparado, sob cada uma das bancadas, o banho de gelo e o banho de água quente.
Inicie a aula levando os alunos para o laboratório de Química da sua escola. Organize os alunos em grupos de três a quatro alunos. Distribua os grupos em cada uma das bancadas do laboratório. Informe aos alunos que eles deverão anotar as observações, pois eles farão um relatório sobre o experimento. Além disso, peça para que um integrante de cada grupo filme o experimento e tire algumas fotos. Entregue para cada grupo o balão volumétrico contendo a reação de equilíbrio. Faça o experimento abaixo, para demonstrar como foi feita a reação de equilíbrio:
Experimento: Obtenção do equilíbrio
Materiais
• Fio de cobre (1 cm de comprimento, com 2-5 mm de diâmetro);
• 1,5 mL de ácido nítrico (HNO3) comercial concentrado;
• Balão volumétrico de 200 mL com tampa (ou uma garrafa de vidro transparente com rolha de cortiça);
• Béquer ou um vidro de maionese;
• Pipeta (ou um conta-gotas limpo de remédio – 1mL equivale a 20 gotas);
• Gelo e água fervendo.
Procedimento:
Em um lugar ventilado, coloque alguns pedaços de fio de cobre em uma garrafa de vidro e adicione com o conta-gotas 1,5 mL de ácido nítrico. Em seguida, tampe a garrafa com a rolha e deixe o gás se formar.
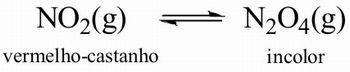
Mostre a formação do gás dentro do balão volumétrico. Eles deverão observar a formação do gás e a variação de cor. Escreva a reação de equilíbrio no quadro, indicando as cores do reagente e do produto, no caso o gás dióxido de nitrogênio (NO2) que apresenta uma coloração castanho–avermelhada é o reagente da reação, e o gás tetróxido de dinitrogênio (N2O4), que é praticamente incolor, é o produto da reação.
Figura 2 – Representação da reação de equilíbrio
Fonte: Elaborada pelo autor
Feito isso, peça para que os alunos coloquem o balão volumétrico sobre o banho de gelo. Após alguns minutos, eles deverão observar a coloração da reação. Após isso, eles deverão colocar o balão volumétrico na água quente. Após alguns minutos, eles deverão observar a coloração da reação.
Figura 3: Alterações na temperatura do equilíbrio
Fonte: http://qnesc.sbq.org.br/online/qnesc21/v21a09.pdf
Experimento retirado do artigo da revista Química Nova na Escola disponível no link: http://qnesc.sbq.org.br/online/qnesc21/v21a09.pdf
Após o experimento peça para que os alunos façam um relatório sobre o experimento, para isso eles deverão elaborar um texto baseado nas respostas das questões propostas abaixo:
1 – Quais os materiais utilizados no experimento?
2 – Quais os procedimentos utilizados para a execução do experimento?
3 – Quais foram as suas observações? O que ocorreu no experimento?
As questões a seguir são referentes às conclusões do experimento
4 – Explique com suas palavras como a temperatura influencia no equilíbrio químico.
5 – Essa reação é endotérmica ou exotérmica? Justifique a sua resposta, baseando-se nas suas observações do experimento.
Reserve o restante da aula para que os alunos concluam essa atividade. No final da aula recolha os relatórios dos alunos. Explique que a alteração da cor da reação de equilíbrio é em função da perturbação gerada pela variação da temperatura, ou seja, o equilíbrio químico favorece a formação do produto quando a temperatura diminuiu; e favorece a formação dos reagentes quando a temperatura aumenta. Por isso, podemos concluir que a reação em questão é uma reação exotérmica. Esse fato pode ser explicado pelo Princípio de Le Chatelier.
Aula 02:
Leve os alunos para o laboratório de informática da escola. Mantenha os alunos nos mesmos grupos da aula anterior. Depois que os alunos se organizarem, peça para que eles pesquisem na internet, em grupo, para encontrar o que diz Princípio de Le Chatelier. Eles deverão pesquisar preferencialmente no site a seguir:
http://nautilus.fis.uc.pt/wwwqui/equilibrio/port/hipertexto/eqq_hiper_texto_04_5.html
Feita essa pesquisa, os alunos deverão escrever com suas palavras o que é o Princípio de Le Chatelier. Em seguida, explique aos alunos que o princípio de Le Chatelier diz que:
Quando uma perturbação externa é imposta a um sistema químico em equilíbrio, esse equilíbrio irá se deslocar de forma a minimizar tal perturbação.
Isso foi o que ocorreu no experimento da Aula 01, onde a perturbação externa, no caso a temperatura, influenciava na formação do reagente e do produto.
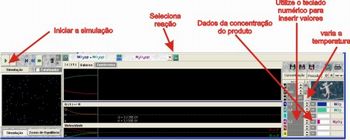
Após isso, peça para que os alunos abram o programa Le Chat 2.1. Explique para os alunos qual a função de cada um dos botões do programa, para isso, consulte o tutorial do programa na parte Preparando a aula. Entregue para os alunos o roteiro de exploração do programa.
Roteiro de exploração do programa Le Chat 2.1
Ao longo da exploração do programa, cada grupo deverá indicar um dos componentes para que faça as anotações pertinentes, essas anotações poderão ser feitas utilizando o editor de texto presente no programa.
Primeiro contato:
• Clique nos botões do programa, e veja para que seve cada um deles. Faça as suas anotações;
• Clique no botão “INICIAR” para que seja gerado o gráfico e identifique quais são as grandezas representadas no gráfico;
Gerando dados:
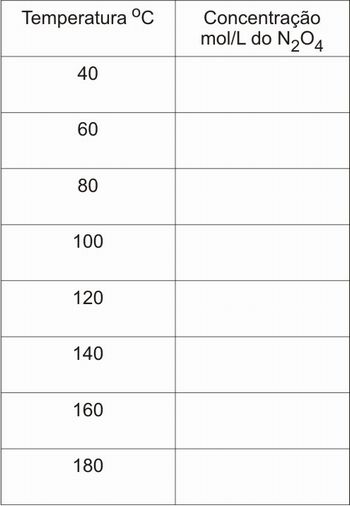
Selecione a reação de equilíbrio do dióxido de nitrogênio, reação trabalhada na Aula 1. Verifique a concentração do produto, N2O4, para várias temperaturas. Para isso, varie a temperatura de 20 em 20 ºC, clicando nas setas para aumentar ou diminuir a temperatura, e verifique a concentração do produto olhando no campo correspondente.
Figura 4 – Como selecionar os dados
Fonte: Elaborada pelo autor
Para facilitar a coleta dos dados, utilize a tabela a seguir:
Tabela 1 – Coleta inicial de dados.
Fonte: Elaborada pelo autor
Após a coleta de dados, responda a questão a seguir:
1 – O que acontece com a concentração do tetróxido de dinitrogênio quando a temperatura aumenta? E quando a temperatura diminui? Elabore uma justificativa para este fenômeno.
Verificando como a concentração influencia no equilíbrio:
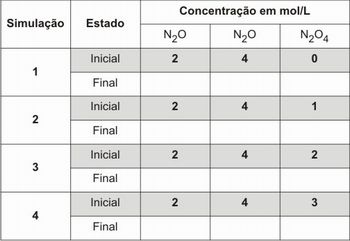
Agora vamos verificar como a concentração de uma das espécies influencia na concentração das outras espécies do equilíbrio. Para isso, continue utilizando a mesma reação. Você deverá aumentar a concentração do produto em uma unidade a cada simulação. Basta utilizar o teclado numérico para inserir os novos valores de concentração, veja na figura 4.
Insira os valores iniciais para cada uma das concentrações e inicie a simulação. Quando a simulação terminar anote os valores finais das concentrações. Utilize a tabela abaixo para anotar os valores, além disso, nessa tabela constam os valores iniciais para cada uma das espécies presentes no equilíbrio.
Tabela 2 – Coleta das concentrações finais
Fonte: Elaborada pelo autor
Em seguida, responda as questões a seguir:
1 – O que aconteceu com a concentração dos reagentes?
2 – Podemos dizer que, para este caso, a variação da concentração do produto é diretamente proporcional? justifique a sua resposta.
3 – Forneça uma explicação para esse fenômeno, baseando a sua resposta no princípio de Le Chatelier.
Aula 3:
Utilize essa aula para explicar os conceitos sobre os fatores que influenciam no equilíbrio químico, para isso utilize as respostas dos alunos presentes no relatório que eles acabaram de fazer. Essa aula também poderá ser utilizada para a conclusão das atividades propostas na aula anterior.
Após as explicações informe aos alunos que será criado um blog. Primeiramente peça para que cada grupo elabore um resumo das informações coletadas ao longo das duas aulas e organizem as fotos e os vídeos. Após a criação do blog, os alunos deverão postar as informações, as fotos e os vídeos, lembrando que os vídeos podem ser postados no YouTube e depois inseridos os links dos mesmos no blog.
Como atividade para casa, proponha aos alunos que eles comentem os vídeos e as fotos dos outros grupos. Posteriormente o professor deverá ler os comentários de cada aluno e utilizá-los para a avaliação.
Para saber como criar o blog clique nos links abaixo:
http://www.stella-science.eu/mini_units/index.php?miniunit=blog
http://www.criarumblog.com/pt/criar-um-blog-gratis/criar-blog-gratis.htm
Ajude os alunos ao longo dessa aula, de modo que cada grupo possa postar as suas idéias. Utilize este blog, para as suas aulas futuras, de modo que o conteúdo de outras aulas poderá ser colocado no blog.
Divulgue o blog por toda a escola.
Recursos Complementares
Para o Professor
• Considerações sobre as aulas de Equilíbrio Químico aplicadas aos alunos do Ensino Médio:
• Simulando o Equilíbrio Químico: Uma Ferramenta para uso dos Professores no Ensino Médio:
http://www.quimica.ufpr.br/eduquim/eneq2008/resumos/R0420-2.pdf
• Equilíbrio Químico - Princípio de Le Chatelier
http://www.uff.br/gqi/ensino/disciplinas/givexp/chatelier.pdf
• Sobre o programa Le Chat
http://www.c5.cl/ieinvestiga/actas/ribie94/Dem2_10.htm
http://www.spq.pt/boletim/docs/boletimSPQ_100_087_23.pdf
• Roteiros de Exploração:
http://nautilus.fis.uc.pt/wwwqui/equilibrio/port/lechat2/roteiros/eqq_lechat2_rot_10_1.html
Avaliação
Avalie a participação dos alunos ao longo das aulas. Avalie as atividades feitas por eles e que foram entregues para o professor. O relatório produzido na segunda aula deverá ser corrigido e entregue para os alunos.
Sem estrelas 0 classificações
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncie opiniões ou materiais indevidos!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus