09/09/2009
Eziquiel Menta
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
O que o aluno poderá aprender com esta aula
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Será necessário que os estudantes saibam identificar as fórmulas dos elementos químicos que constam na tabela periódica bem como de que forma obter equilíbrio químico a partir das equações.
Estratégias e recursos da aula
Educadores, esta aula também pode ser trabalhada com os estudantes que freqüentam a EJA basta que os conteúdos sejam contextualizados.
Verificando conhecimentos prévios
Inicie esta aula encaminhando a turma para o laboratório de química para que desenvolvam o experimento Evidências de uma Reação Química. Nesta ação os estudantes devem observar sinais que evidenciam a presença de reações químicas. Link do experimento:
http://www.cienciamao.if.usp.br/tudo/exibir.php?midia=amm&cod=_evidenciasdeumareacaoquimica

Educadores para iniciar esta aula apresente a notícia abaixo para a turma e provoque um debate perguntando:
O que é corrosão? Como se forma a corrosão de metais? Que processos químicos estão presente neste fenômeno?
Corrosão é um processo resultante da ação do meio sobre um determinado material, causando sua deterioração. É um fenômeno que está associado à ferrugem que é aquela camada de cor marrom-avermelhada que geralmente se forma em superfícies metálicas. A ferrugem nada mais é do que o desgaste sofrido pelas construções que representam os sinais de reações químicas. Este fenômeno não ocorre somente com metais mas também com outros materiais dentre eles os polímeros orgânicos, o concreto, eletrodomésticos, grades, instalações industriais, automóveis, etc.

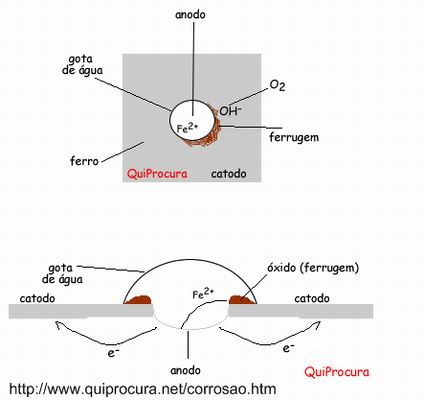
Informe à turma como a ferrugem pode ser representada na equação química.
Formação da Ferrugem
Reação anódica (oxidação): Fe ---> Fe2+ + 2e– (1)
Reação catódica (redução): 2H2O + 2e– ---> H2 + 2OH– (2)
Neste processo, os íons Fe2+ migram em direção à região catódica, enquanto os íons OH - direcionam-se para a anódica.
Em uma região intermediária, ocorre a formação do hidróxido ferroso:
Fe2+ + 2OH– ---> Fe (OH)2 (3)
Em meio com baixo teor de oxigênio, o hidróxido ferroso sofre a seguinte transformação:
3Fe(OH)2 ---> Fe3O4 + 2H2O + H2 (4)
Caso o teor de oxigênio seja elevado
2Fe(OH)2 + H2O + 1/2O2 ---> 2Fe(OH)3 (5)
2Fe(OH)3 ---> Fe2O3.H2O + 2H2O (6)
Produto final da corrosão (ferrugem): Fe3O4 (coloração preta) e Fe2O3.H2O (coloração alaranjada ou castanho- avermelhada).
Produzir a corrosão metálica é possibilitar a transformação de um material metálico ou liga metálica pela sua interação química ou eletroquímica por meio de exposição.
Apresente a imagem abaixo e explica como ocorre na prática a corrosão.

Solicite aos estudantes que pesquisem sobre o elemento químico cobre, produzam um texto e disponibilizem em um blog no link: www.blogger.com/start

Representar as fórmulas química do elementos abaixo:
• hidróxido de cobre I
• hidróxido de cobre II
• carbonato de cobre I
• carbonato de cobre II
Elaborar a equação de reação do cobre quando exposto à ação do oxigênio e da umidade onde pode ocorrer a formação de azinhavre.
Após encaminhe os estudantes ao Laboratório de Química e incentive-os à desenvolverem o experimento abaixo que está disponível no link: http://www.cliquequimica.com.br/receitas.htmExperimento: Gravando em placa de cobre
Objetivo: compreender o fenômeno da corrosão de metais na fabricação de peças artesanais
Materiais
- placa de cobre pequena (cerca de 1,5 cm x 3,5 cm)
- letras adesivas autocolant es (do tipo letraset)
- fita-crepesolução saturada de cloreto de ferro III, FeCl3(aq)
- béquer ou recipiente semelhante de vidro refratário
- fôrma para ba nho-maria
- pinça de madeira
Procedimentos
- Cole as letras adesivas na placa de cobre previamente limpa e desengordurada,
- Escreva o nome do cachorro.
- No verso da placa de cobre escreva o número do seu telefone, também utilizando a letraset.
- Prepare uma solução aquosa saturada de cloreto de ferro III ou clor eto férrico, FeCl3(aq).
- Coloque água na fôrma e leve-a ao fogo.
- Adicione a solução em um recipiente de vidro refratário e arrume-o dentro da fôrma (em banho-maria) para aquecer.
- Mergulhe a placa de cobre dentro do recipiente de vidro refratário (na solução em banho-maria) e deixe-a em aquecimento por pelo menos 50 minutos.
- Retire a placa de cobre da solução com a ajuda de uma pinça de madeira, enxágüe-a em água corrente e retire as letras autocolantes.
Representação da reação da solução de cloreto férrico provocando a corrosão na placa de cobre:
1 Cu(s) + 2 FeCl3(aq) -> 1 CuCl2(aq) + 2 FeCl2(aq)
Quando o cobre é exposto à ação do oxigênio e da umidade, pode o correr a formação de azinhavre, uma mistura (bastante tóxica) de hidróxido de cobre I, hidróxido de cobre II, carbonato de cobre I e carbonato de cobre II. Desta for ma, considera-se prudente envernizar a placa antes de que o animal a utilize.
Relatório
Solicite que ao desenvolverem o experimento conjecturem e façam os apontamentos que julgarem necessário de forma a ir construindo um bom relatório. Assim, disponibilizamos um modelo que pode ser acessado no link abaixo:
Link: www.sitedaescola.com/aulas_inovadoras/marco_amaral/Relat%f3rio.doc
Ao concluir o relatório este deverá ser disponibilizado em um blog no link: .
Link: www.blogger.com/start

Antes de disponibilizar os relatórios sobre os resultados da atividade prática no blog, as equipes deverão entregar uma cópia do relatório para o professor e apresentar os resultados para a turma em um seminário organizado para tal finalidade. É neste momento que o(a) educador(a) deve fazer suas considerações de forma a ajustar o que for necessário quanto ao conteúdo.
Recursos Complementares
Livro: Quimica Interativa. Martha Reis. FTD.
http://www.cliquequimica.com.br/receitas.htm
http://pt.wikipedia.org/wiki/Corros%C3%A3o
http://www.rioboatshow.com.br/rbs2005/paragon/corrosao_de_metais.doc.
Chisholm, Jane; Johnson, Mary. Introdução à Química. Lutécia. 1983.Rio de Janeiro, RJ.
Avaliação
Educador, as interações, descobertas, participação nas atividades desenvolvidas em equipe devem ser objeto de análise. A avaliação diagnóstica e processual também deverá ser priorizada nesta aula. Pode-se trabalhar com notas e ou conceitos de maneira que sejam sempre somátorios. É importante que se apresente a proposta de trabalho para os estudantes para saibam os critérios pelos quais serão avaliados além de como os objetivos devem ser alcançados.
Sem estrelas 0 classificações
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncie opiniões ou materiais indevidos!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


