30/11/2010
CLÁUDIA REGINA M. G. FERNANDES
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Biologia | Origem e evolução da vida |
| Ensino Fundamental Final | Ciências Naturais | Terra e universo |
O que o aluno poderá aprender com esta aula
1) Reconhecer experimentalmente a presença do gás oxigênio na biosfera
2) Conhecer o modelo atômico do oxigênio
3) Verificar a importância do gás oxigênio para os seres vivos e para a vida na Terra
4) Estabelecer relação entre o gás oxigênio, tecnologias e saúde
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Atmosfera, componentes do ar, respiração
Estratégias e recursos da aula
ATIVIDADE 1
Trabalhando com texto:
O Oxigênio
O oxigênio, elemento químico de símbolo O, pertencente ao grupo dos calcogênios (VIa), foi descoberto por Priestley em 1722. A partir de 1775, Lavoisier estabeleceu suas propriedades, mostrou que existia no ar e na água, e indicou seu papel fundamental nas combustões e na respiração. Coube ao químico francês Antoine Lavoisier mostrar que a combustão e a respiração são fenômenos relacionados entre si, pois são todos processos de combinação com o oxigênio.
Propriedades físicas e químicas do oxigênio
O oxigênio natural é um gás incolor e inodoro, com densidade 1,105, que só liquefaz a -138º C, consiste numa mistura de três isótopos estáveis: o oxigênio 16 (99,758%), o oxigênio 17 (0,37%) e o oxigênio 18 (0,204%). Pouco solúvel em água, forma bolhas que se desprendem facilmente por simples agitação. À temperatura ambiente, a molécula de oxigênio é relativamente inerte, mas na presença de substâncias catalisadoras ou ao ser aquecida, reage com a maioria dos elementos para formar vários compostos. Na baixa atmosfera e à temperatura ambiente, o oxigênio está presente principalmente na forma de moléculas diatômicas (O2) que constituem um gás incolor, inodoro e insípido, essencial para os organismos vivos. Apresenta densidade levemente superior à do ar e seus átomos são respectivamente pequenos, pois possuem oito elétrons (partículas elementares de carga negativa). Muito eletronegativo, une-se aos ametais (com exceção dos halogênios) e aos metais, salvo o ouro e a platina. Essas combinações, que em geral desprendem calor, são chamadas “combustões” e podem ser vivas ou lentas. É o elemento mais abundante do globo terrestre. Constitui aproximadamente um quinto do ar, oito nonos do peso da água; figura na maioria dos constituintes do solo (silicatos, carbonatos) e das substâncias orgânicas. Sua combustão fornece vapor de água e gás carbônico, mas, se o oxigênio se encontra em quantidade insuficiente, o hidrogênio queima antes do carbono, do qual uma parte torna a chama brilhante e aparece sob forma de negro-de-fumo.
Processos de oxidação
A reação espontânea de qualquer substância com o oxigênio é denominada oxidação (termo que também designa qualquer processo na qual uma substância perde elétrons). Quando a reação é imediata e produz calor e luz, chama-se combustão. São exemplos de processos de oxidação: a corrosão do ferro e a putrefação da madeira, que formam óxidos de ferro e de carbono, respectivamente. A queima da madeira gera os mesmos produtos de sua putrefação: dióxido de carbono e água. Os fenômenos de combustão podem ser espontâneos e, em substâncias como o carvão betuminoso, provocar incêndios em virtude da reação instantânea entre oxigênio, carbono e hidrogênio.
Aplicações
São inúmeras as aplicações do oxigênio na indústria. Vários tipos de maçaricos — como os oxiacetilênicos, produtores de feixes de grande conteúdo energético, que soldam ou seccionam metais; os oxídricos, que fabricam delicados dispositivos de quartzo e platina; e os de gás, úteis no tratamento de vidros — permitem a realização de tarefas específicas de soldura nas indústrias de base e de construção. O oxigênio líquido, misturado a outros combustíveis é utilizado como explosivo. Certos trabalhos que exigem a permanência do homem em ambientes hostis demandam o transporte do oxigênio necessário à respiração. Submarinos, aviões, naves espaciais, prospecções minerais e geológicas a grandes profundidades são abastecidos com tanques e bombas de oxigênio quando não é possível empregar dispositivos de injeção de ar a partir do exterior. Nos centros médicos é comum a administração de oxigênio a pacientes asmáticos ou com problemas pulmonares. Também é aconselhável em processos de envenenamento, nos quais é preciso acelerar os mecanismos de oxidação do sangue. Textos adaptados. Fonte de consulta: http://www.tabela.oxigenio.com/nao_metais/elemento_quimico_oxigenio.htm
1) Professor/a,sugira que os/as alunos/as procurem o significado das seguintes palavras:
calcogênios - combustão - respiração - inodoro - densidade - catalisadora - diatômica - insípido - silicato - carbonato - oxidação - corrosão - putrefação
2) Proponha que eles respondam por escrito as questões abaixo: Esta atividade poderá ser feita em duplas ou trios, possibilitando trocas de conhecimentos.
3) Grife no primeiro texto as informações que você considerou mais relevantes.
4) Quais são as propriedades químicas e física do oxigênio?
5) O que significa a palavra combustão?
6) Qual é a proporção de oxigênio na atmosfera?
7) O que é oxidação? Explique como acontece esse processo.
8) Onde e como se utiliza o oxigênio?
ATIVIDADE 2
REALIZANDO EXPERIMENTO...
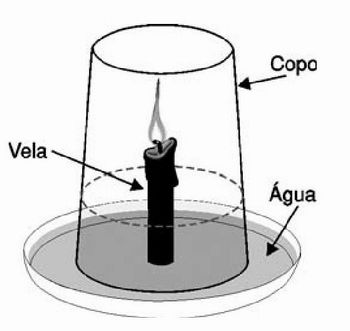
Material a ser utilizado: recipiente (pode ser um prato) com água, um copo pequeno, um copo grande, uma vela, fósforo, um relógio que marque os segundos.
Procedimento:
1) Acenda a vela e coloque-a no recipiente com água.
2) Cubra-a com o copo pequeno.
3) Observe o tempo que a vela leva para apagar-se. Anote o tempo.
4) Retire o copo pequeno, reacenda a vela e cubra-a com o copo grande.
5) Observe o tempo que ela permanecerá acesa e anote na tabela.
* Utilizamos somente de um copo para ilustrar esta experiência.
Fonte de consulta: http://www.sabereletronica.com.br/secoes/leitura/119
Agora, responda as perguntas:
1) De acordo com os seus dados, em qual dos copos a vela permanece mais tempo acesa: em A ou B ?
2) Como você explica este fato?
3) Como se classifica o oxigênio pelo seu papel na combustão?
4) O que é um comburente?
5) Para que haja a combustão, do que se necessita além do comburente?
6) O que se pode concluir a partir desta experiência?
ATIVIDADE 3
VIVENCIANDO A INTERDISCIPLINARIDADE...
Estas atividades podem ser desenvolvidas em parceria com professores/as de outros conteúdos:
EDUCAÇÃO ARTÍSTICA: Construção do modelo atômico do oxigênio
MATEMÁTICA: Construção de gráficos, com o objetivo de comparar os componentes do ar e suas devidas proporções.
LÍNGUA PORTUGUESA: Elaboração de relatório que conste todos os procedimentos da experiência realizada bem como os resultados e conclusões.
Recursos Complementares
Avaliação
A avaliação dos/as alunos/as poderá ser feita em todos os momentos da aula, portanto, será processual. Todos os recursos utilizados podem servir como instrumentos avaliativos. Assim sendo, é importante avaliar o desenvolvimento de cada aluno na elaboração e participação em todas as atividades propostas em sala de aula.
Cinco estrelas 1 classificações
- Cinco estrelas 1/1 - 100%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
kauane veloso, África do Sul - disse:
kauhanne-veloso@hotmail.com23/09/2014
Cinco estrelaslegal
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus