29/08/2008
Wildson Luiz Pereira dos Santos
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
O que o aluno poderá aprender com esta aula
• A partir do conceito de polaridade determinar a afinidade do álcool com a água;
• Identificar o teor de álcool na gasolina;
• Fazer cálculo de teor de materiais.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
• Polaridade das ligações químicas.
Estratégias e recursos da aula
Conteúdos específicos:
- Substâncias polares e apolares;
- Interações intermoleculares entre substâncias polares.
Recursos educacionais:
- 200.189.113.123/diaadia/diadia/arquivos/File/conteudo/objetos_de_aprendizagem/QUIMICA/sim_qui_gasolinaadulterada.swf. Clique no link para visualizar a animação presente no site do LabVirt;
- www2.fc.unesp.br/lvq/exp02.htm. Clique no link para visualizar o experimento.
Preparando a aula:
Na aula anterior, peça para que os alunos façam uma pesquisa sobre qual o teor de álcool permitido na gasolina de acordo com a legislação vigente.
Introduzindo a aula: (5 min.)
Para introduzir a aula faça a seguinte pergunta aos alunos: Como saber se a gasolina do posto de combustível está adulterada?
Desenvolvendo a aula: (30 min.)
Após as respostas dos alunos, explique que eles irão executar uma simulação que se baseia na polaridade das moléculas para determinar o teor de álcool na gasolina e irão comparar com o teor encontrado nas especificações da lei.
De acordo com a disponibilidade de computadores e com a quantidade de alunos, caso necessite, divida a turma em grupos de três ou quatro alunos. Execute simulação do LabVirt sempre orientando os alunos. Depois disso, peça para os alunos abrir o roteiro experimental e observarem a figura 1 e a figura 2, em seguida peça para eles responderem as seguintes perguntas:
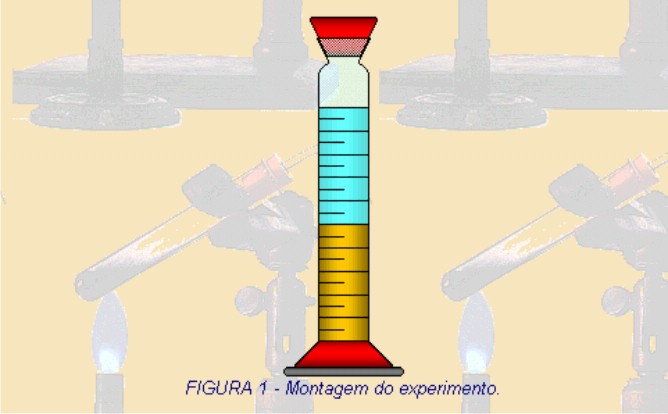
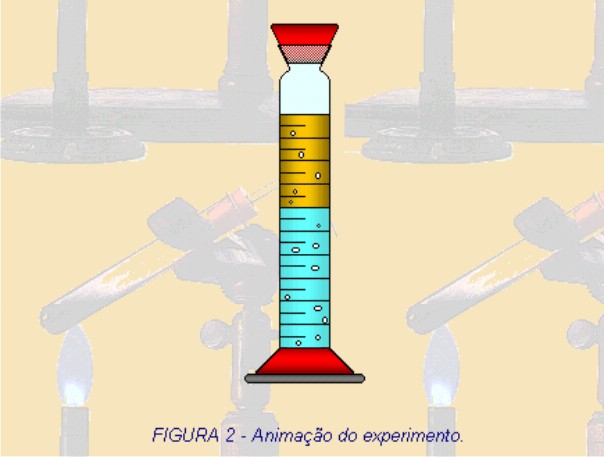
1 – A figura 1 representa o início do experimento no qual é adicionado 50 mL de água acima da gasolina. Observe que nesta representação apenas indica que foi colocado a água sobre a gasolina, porém na prática durante a adição a água não ficaria acima da gasolina e sim abaixo. Explique por quê? (densidade)
2 – Ao observar a figura 2, o que aconteceu com o volume da fase aquosa? Explique o que ocorreu.
Depois das respostas dos alunos, explique que a densidade da água é maior do que a densidade da gasolina, por isso quando misturamos os dois materiais a água fica em baixo da gasolina.
Além disso, quando misturamos os dois materiais ocorreu um aumento do volume da fase aquosa. Isso ocorreu porque a o álcool dissolvido na gasolina, por possuir uma maior afinidade com a água em função da polaridade, foi solubilizado n a água. Explique aos alunos que esse fato é provocado por:
As cargas elétricas não são distribuídas de uma forma homogênea, fazendo com que partes distintas das moléculas fiquem positivas e outras negativas. As moléculas que possuem cargas elétricas deslocadas são denominadas polares e as que não possuem são apolares. Substâncias polares podem interagir entre si, já que suas extremidades polares podem atrair as extremidades de cargas opostas das moléculas de outras substâncias. Já moléculas apolares não interagem da mesma forma com moléculas polares de outras substâncias, pois elas não conseguem romper as interações intermoleculares polares dessas outras. Isso leva a um importante princípio prático de previsão de solubilidade das substâncias: substâncias polares dissolvem substâncias polares; as apolares dissolvem as apolares; e uma substância polar dificilmente vai dissolver uma apolar.
Em seguida, explique aos alunos como calcular a porcentagem de álcool na gasolina:
50 mL — 100%
V — x %
Onde V é o volume adicional do álcool em água.
Sistematizando a aula: (15 min.)
Após a execução do experimento peça para que os alunos entregue o relatório sobre o experimento.
Relatório
- Considerando o álcool como a única substância adicionada à gasolina, explique o que ocorreu quando a mistura gasolina com água foi agitada.
- Com base nos dados obtidos, calcule a porcentagem de álcool existente na gasolina analisada e diga se a gasolina se encontra dentro ou fora dos padrões estabelecidos por lei.
- De acordo com o conceito de polaridade, explique por que o álcool que estava dissolvido na gasolina ficou dissolvido na água?
- Em outro experimento, foram adicionados 50 mL de água em 50 mL de gasolina, após agitar a mistura, percebemos que a fase incolor (aquosa) estava com 80 mL. Determine a porcentagem de álcool na gasolina analisada.
Sugestões de alternativas para o desenvolvimento da aula:
Caso o professor tenha à sua disposição um la borató ;rio de química com uma capela, poderá logo após a execução da animação presente no LabVirt, colocar em prática o experimento que se encontra no site do Laboratório Virtual de Química de UNESP Bauru: http://www2.fc.unesp.br/lvq/exp02.htm
O professor necessitará de uma capela, pois os vapores que são gerados ao longo do experimento são inflamáveis e podem gerar riscos aos alunos.
Para complementar a avaliação o professor poderá propor as questões abaixo:
- Por que após a mistura a gasolina ficou acima da solução salina?
- Por que o volume da gasolina diminui após a mistura?
- Por que neste roteiro se pede para usar solução salina?
Avaliação
Quatro estrelas 10 classificações
- Cinco estrelas 7/10 - 70%
- Quatro estrelas 2/10 - 20%
- Três estrelas 1/10 - 10%
- Duas estrelas 0/10 - 0%
- Uma estrela 0/10 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
amanda , IFTO , Tocantins - disse:
amannda57@gmail.com07/06/2012
Três estrelaso volume da gasolina diminui pq o alcool que tinha na gasolina foi para a água..
-
FILIPE CORDEIRO, escola estadual bernardino gomes da luz , Mato Grosso - disse:
filipeexplorer@hotmail.com28/10/2011
Cinco estrelasGOSTEI MUITO DA EXPERIENCIA, SIMPLES, RAPIDA E DIRETA.
-
Ludmilla, ETEC Cônego José Bento curso técnico química , São Paulo - disse:
lud-michele@hotmail.com08/12/2010
Cinco estrelasMuito bom, me ajudou a preparar meu relatório e entender perfeitamente a aula.
-
RENILTON, ufmt , Mato Grosso - disse:
renilton@wattbras.com.br06/08/2010
Cinco estrelaso modo em que vc mostrou como fazer essa observação ficou muito bom... um pedido será que existe um programa para fazer correção de densidade de derivados de petróleo e de alcool? se tiver tem como vc mostrar em que site eu encontro...
-
Luan Oliveira, Sigla: CETEP extremo sul , Bahia - disse:
luan94oliveira@gmail.com07/07/2010
Quatro estrelasGostei da aula e conseguir fazer um relatorio baseado no que vi nesta janela.
-
Maria Maraiana Rocha, Colégio São Francisco de Sales - Diocesano , Piauí - disse:
mariana_zuzu@hotmail.com29/04/2010
Cinco estrelasperfeitoo, todas as informações que eu procurava testavam aqui, Obrigada:)
-
Rafael, Nenhuma , São Paulo - disse:
rafael.ribeiro.alves93@hotmail.com15/04/2010
Cinco estrelasvaleu era exatamente oq eu estava precisando
-
Vanessa, nova marabá , Pará - disse:
vane_27_yes@hotmail.com24/03/2010
Cinco estrelasotimo! as aulas praticas e a aplicaçao de teorias nas atividades do cotidiano torna o conteudo de quimica mas interessante...opiniao de aluno!
-
ana cristina, ana cristina , Maranhão - disse:
ana_quimica@yahoo.com.br24/03/2010
Quatro estrelasacho que vc poderia explorar mais sobre a determinação do do teor de álcool, tipo assim, colocar um exemplo com resolução...
-
Érica, C.E.Frei Tomás , Rio de Janeiro - disse:
epduarte1@yahoo.com.br24/03/2010
Cinco estrelasInteressante. Podemos utilizar mamadeiras (material de fácil acesso) para estar fazendo a experiência.
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


