18/07/2008
Wildson Luiz Pereira dos Santos
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
O que o aluno poderá aprender com esta aula
• Caracterizar matematicamente as Leis do estado Gasoso;
• Determinar os valores das variáveis nas diferentes leis.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
• Conversão de Unidades;
• Modelo Explicativo do Comportamento dos Gases;
• Análise gráfica.
Estratégias e recursos da aula
Conteúdos específicos:
• Lei de Charles e Gay-Lussac;
• Segunda Lei de Charles e Gay-Lussac;
• Lei de Boyle.
Recursos educacionais:
Clique aqui para baixar o programa educativo Ideal Gás in 3D;
Introduzindo a aula: (5 min.)
O que acontece com o volume de um gás quando ele é aquecido?
Desenvolvendo a aula: (25 min.)
Em sala de aula:
Após as respostas dos alunos, explique como as três grandezas do estado gasoso se comportam entre si, considerando uma massa fixa de gás, explicando assim as três transformações gasosas:
A transformação Isobárica é conhecida como a Lei de Charles e Gay-Lussac. Nessa transformação, para uma massa fixa de gás, mantemos a pressão constante e verificamos que o volume é diretamente proporcional à temperatura. Matematicamente, essa lei pode ser representada pela equação:
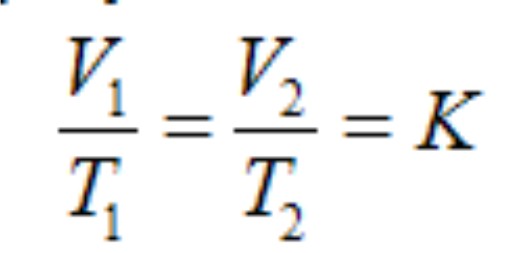
Em que V1 e T1 são o volume e a temperatura iniciais; V2 e T2 são o volume e a temperatura finais; e K é um valor constante.
A transformação isocórica (ou isométricas, ou isovolumétricas) é conhecida como a Segunda Lei de Charles e Gay-Lussac. E pode ser descrita segundo o enunciado: A pressão exercida por uma massa fixa gasosa, sob volume constante, é diretamente proporcional à sua temperatura termodinâmica. A partir dessa lei podemos deduzir a expressão matemática:
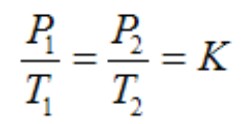
A transformação isotérmica é conhecida como a Lei de Boyle. Essa lei pode ser enunciada da seguinte forma: O volume de uma quantidade em massa fixa de gás, a temperatura constante, é inversamente proporcional a uma pressão exercida sobre ele. A Lei de Boyle pode ser descrita pela seguinte equação matem& ;aac ute;tica:
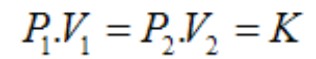
Após a explicação das três leis dos gases, explique que se elas forem combinadas, podemos estabelecer uma lei geral. Se combinarmos a Lei de Boyle com a Lei de Charles, constatamos que o volume é inversamente proporcional à pressão e diretamente proporcional a temperatura, ou seja:
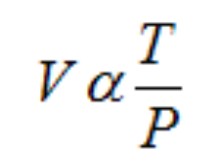
em que α representa proporcionalidade. Matematicamente, quando temos uma proporção, ela pode ser representada por um valor constante (k). Assim a relação anterior pode ser convertida em:
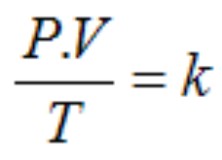
Então, se submetermos uma determinada quantidade de gás a qualquer variação, suas condições iniciais e finais serão dadas pelas equações:
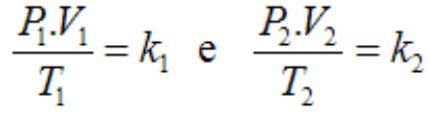
Para uma mesma quantidade de gás, as constantes k1 e k2 são iguais:
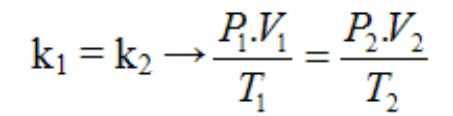
A equação acima é conhecida como a equação geral dos gases. Ressalte que essas leis para o estado gasoso foram estabelecidas para uma massa fixa de gás.
Após as explicações, diga aos alunos que eles iniciarão um programa, onde eles poderão constatar essas leis através de uma simulação. Os alunos deverão seguir o roteiro presente na parte de sistematização das aulas.
Sistematizando a aula: (20 min.)
No laboratório de Informática
Após a explicação peça para que os alunos formem grupos com três ou quatro alunos e explique o funcionamento do programa Ideal Gás in 3D. Em seguida, entregue as questões que os alunos deverão responder analisando o programa:
Questões sobre o programa:
1) No software a Segunda Lei de Charles e Gay-Lussac recebe o nome de transformação isocórica. Sendo assim, qual a relação existente entre as variáveis pressão e temperatura? Qual a expressão matemática que rege esse comportamento.
2) Uma garrafa contém um gás a uma pressão de 1 atm e temperatura de 25 ºC. A garrafa foi colocada ao sol e a temperatura aumentou para 30 ºC. Considerando que não ocorra variação de volume responda:
a) Qual Lei dos gases rege esse caso?
b) Determine a pressão final na garrafa.
3) Na Lei de Boyle, qual variável é mantida constante? Como se relacionam as outras variáveis?
Anexo
Programa Educativo Ideal Gás in 3D
Este anexo contém informações de como manusear o programa. Foi feito com a intenção de auxiliar o professor, uma vez que o programa é em língua inglesa.
O programa é uma simulação das transformações gasosas, em que o usuário pode variar uma das grandezas do estado gasoso, enquanto uma é mantida constante, e verificar como a terceira grandeza se comporta. Abaixo temos a janela do programa:
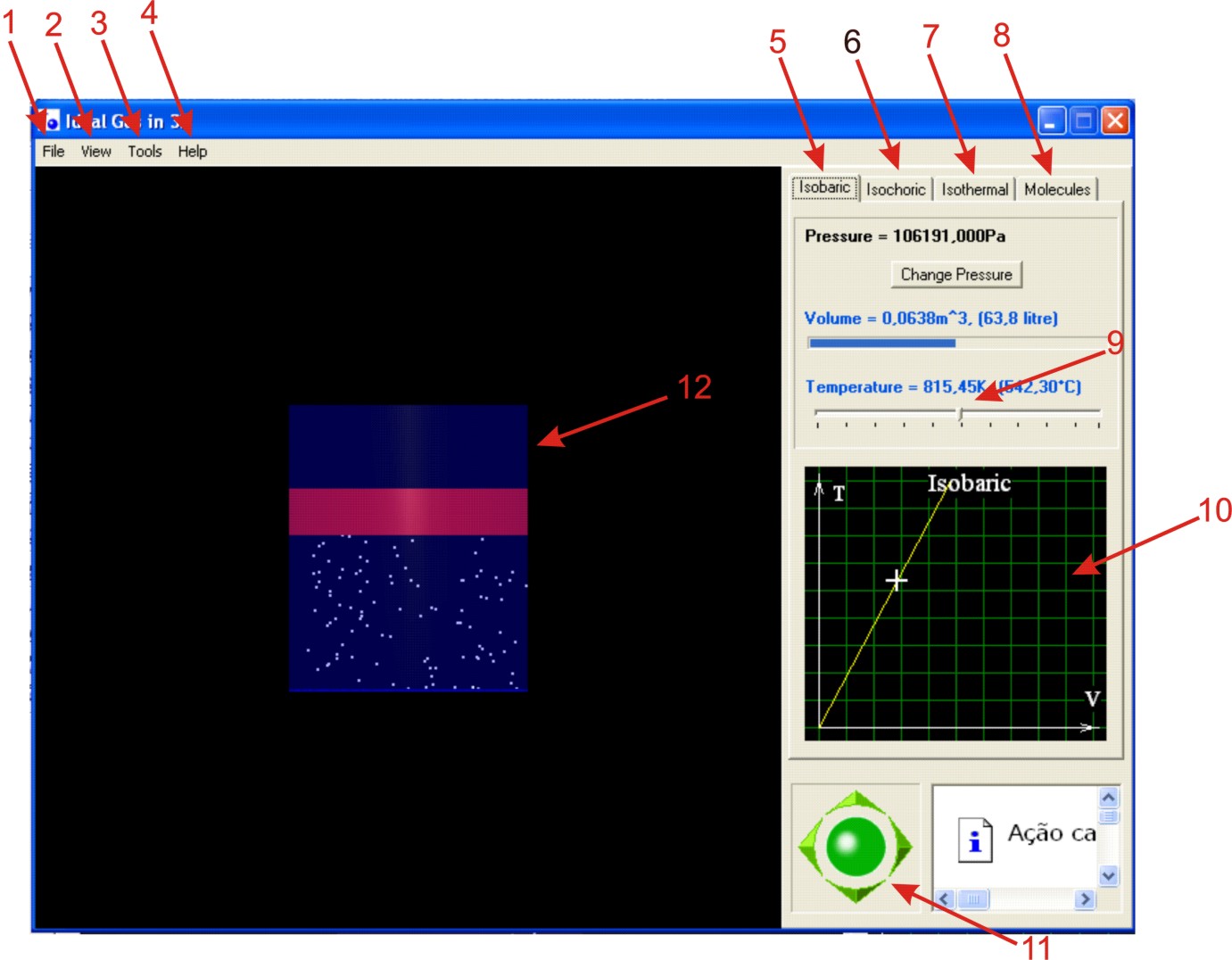
1. Arquivo – permite que o usuário saia do programa;
2. Exibir – permite que o usuário transite pelos tipos de transformações;
3. Ferramentas – permite que o usuário altere as configurações de cores do gráfico;
4. Ajuda – contém o manual do programa com algumas introduções teóricas sobre o assunto, em inglês;
5, 6, 7 e 8. Possibilita ao usuário navegar entre as transformações gasosas e a distribuição gasosa;
9. Cursor onde o usuário pode variar uma das grandezas;
10. Visualização do gráfico;
11. Permite mover o recipiente no centro da janela do programa;
12. Simulação de um recipiente com partículas de um gá ;s dentro.
Avaliação
Quatro estrelas 2 classificações
- Cinco estrelas 1/2 - 50%
- Quatro estrelas 0/2 - 0%
- Três estrelas 1/2 - 50%
- Duas estrelas 0/2 - 0%
- Uma estrela 0/2 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
diba, eu , São Paulo - disse:
digovizcarra@hotmail.com13/11/2012
Cinco estrelasgostei explico uma coisa q a professora nao conseguiu fazer obg
-
joana, UNB , Distrito Federal - disse:
Joana002@hotmail.com24/03/2010
Três estrelasacho formal de mas,deveria mudar um pouco as palavras e da uma explicação mais detalhada!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


