14/01/2011
Cláudia Regina M. G. Fernandes
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Fundamental Final | Ciências Naturais | Tecnologia e sociedade |
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
O que o aluno poderá aprender com esta aula
- Introduzir os conceitos de ligações químicas.
- Identificar e caracterizar os diferentes tipos de ligações químicas.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Para essa aula os alunos deverão ter aprendido sobre: átomos, tabela periódica, distribuição eletrônica, número de valência.
Estratégias e recursos da aula
Professor quer saber mais sobre as ligações químicas?
Leia: http://pt.wikipedia.org/wiki/Liga%C3%A7%C3%A3o_covalente
http://luizclaudionovaes.sites.uol.com.br/ligaquim.htm
Atividade 1: Descobrindo as ligações químicas
Professor inicie a aula questionando aos alunos:
1. O que é uma ligação?
2. Para que serve uma ligação?
Peça para que discutam e anotem as respostas no caderno. Em seguida, intervenha apresentando para os alunos as ligações químicas, os tipos e as características de cada uma. Se quiser pode utilizar os vídeos abaixo para enriquecer ainda mais a atividade. Ao término da intervenção peça para que os alunos redijam um texto abordando os seguintes itens:
*O que são as ligações químicas?
*Quais são os tipos de ligações químicas?
*Caracterize e exemplifique cada tipo de ligação química.
Fonte: http://fichariodeciencias.zip.net/images/crayons-05.gif
Vídeo 1. http://www.youtube.com/watch?v=rRqbXuCB2BU
Vídeo 2. http://www.youtube.com/watch?v=w5W7uiLp9F4&feature=related
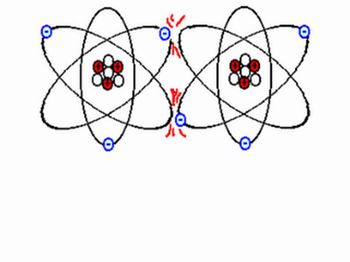
Atividade 2: Representando as ligações químicas
Fonte: http://4.bp.blogspot.com/_PqQSwnED_iQ/RzDHK3B231I/AAAAAAAAAAk/qJqYswQA_2g/s320/COV1.gif
Professor para realização dessa atividade será necessário materiais como: massa de modelar, papéis coloridos, canudinhos, tampinhas, e outros que julgar adequados para representar os diferentes tipos de ligações. Uma sugestão é aproveitar materiais ou trabalhar com reciclados.
Peça aos alunos que se organizem em equipes de no máximo cinco pessoas. Os alunos poderão consultar suas anotações, bem como o livro didático e outras fontes de informação como sites, revistas, vídeos.
Solicite aos alunos que relembrem os tipos de ligações químicas estudas. Em seguida, apresente os materiais disponíveis e peça para que as equipes represente os tipos de ligações químicas. Enfatize que a criatividade para essa atividade é imprescindível!
Depois que as equipes confeccionarem os materiais faça uma rodada de apresentação. Durante a apresentação deve ser abordada a escolha do material e também o conteúdo de ligações químicas.
Atividade 3: V ou F das ligações químicas
Professor confeccione placas com as letras V (verdadeiro) e F (falso) e sentenças que podem ser verdadeiras ou falsas.
Os alunos poderão continuar trabalhando na mesma equipe da atividade anterior. Cada equipe deverá receber duas placas, uma com a letra V e outra com a letra F.
Fonte: http://farm4.static.flickr.com/3600/3389446035_23735dde3e.jpg
Para iniciar a atividade leia uma sentença, os integrantes das equipes deverão levantar a mão para pedir o direito de resposta. A equipe que levantar a mão primeiro responde. Se a resposta estiver correta marcam ponto, se a resposta estiver errada perdem o direito de participar da próxima rodada, e se não souberem outro grupo poderá tentar responder. As sentenças que forem falsas devem ser corrigidas pela equipe.
Sugestões de sentenças:
Os gases nobres é o grupo de átomos encontrado na forma monoatômica pelo fato de serem estáveis.
Verdadeira
1. Um elemento químico de configuração eletrônica 1s2 2s2 2p6 3s2 3p5 possui forte tendência para perder 5 elétrons.
Falsa
Tornando a sentença verdadeira: Um elemento químico de configuração eletrônica 1s2 2s2 2p6 3s2 3p5 possui forte tendência para ganhar um elétron.
2. Para que um átomo neutro de cálcio se transforme em Ca2+, ele deve perder dois elétrons.
Verdadeira
3. Para adquirir configuração eletrônica de um gás nobre, o átomo de número atômico 16 deve perder 2 elétrons.
Falsa
Tornando a sentença verdadeira: Para adquirir configuração eletrônica de um gás nobre, o átomo de número atômico 16 deve receber 2 elétrons.
4. Um composto iônico é geralmente formado a partir de elementos que possuem massas atômicas elevadas.
Falsa
Tornando a sentença verdadeira: Um composto iônico é geralmente formado a partir de elementos que possuem energias de ionização muito distintas entre si.
5. Nas condições ambientes, os compostos iônicos são sempre sólidos.
Verdadeira
6. Os elementos P e Br podem combinar-se formando a substância PBr3, covalente.
Verdadeira
Outros professores também podem colaborar para essa aula:
Artes - o professor poderá contribuir discutindo com alunos os materiais e as formas de como representar as ligações químicas (atividade2)
Português - o professor poderá ajudar na estruturação e correção ortográfica do texto solicitado na atividade 3
Recursos Complementares
Vídeo:
http://www.youtube.com/watch?v=vjETqU7-1RY&feature=related
Sites para pesquisa:
http://pt.wikipedia.org/wiki/Liga%C3%A7%C3%A3o_covalente
http://pt.wikipedia.org/wiki/Liga%C3%A7%C3%A3o_i%C3%B4nica
http://pt.wikipedia.org/wiki/Liga%C3%A7%C3%A3o_met%C3%A1lica
Avaliação
O processo de avaliação será contínuo. Sendo o professor responsável por verificar se os alunos estão sendo sujeitos ativos nas aulas. Observe se estão se envolvendo nas atividades e cumprindo com as tarefas designadas a cada um.
Três estrelas 1 classificações
- Cinco estrelas 0/1 - 0%
- Quatro estrelas 0/1 - 0%
- Três estrelas 1/1 - 100%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Abraão dos Santos Matos, EE - COLEGIO ESTADUAL DONA AMELIA AMADO , Bahia - disse:
abraaoquimico@hotmail.com30/05/2012
Três estrelasAchei interessante a sequência didática utilizada.
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus