17/01/2011
Cláudia Regina M. G. Fernandes
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Fundamental Final | Ciências Naturais | Tecnologia e sociedade |
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
O que o aluno poderá aprender com esta aula
1. Apresentar o conceito de pH.
2. Identificar a existência dos indicadores mais comuns de pH, como a Fenolftaleína e o Azul de Timol.
3. Mostrar o repolho roxo como indicador ácido-base.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Para essa aula os alunos deverão conhecer sobre: fórmula química e classificação das substâncias.
Estratégias e recursos da aula
Atividade 1: Sensibilização para a discussão do pH
Fonte: http://macmagazine.com.br/wp-content/uploads/2009/04/10-ph.jpg
Professor essa atividade poderá ser realizada no laboratório de informática da escola, ou mesmo em sala de aula. Disponibilize o endereço eletrônico (abaixo) ou leve o material impresso para que os alunos possam fazer a leitura.
Reportagem:
Altas emissões de CO2 estão deixando os oceanos ácidos, o que pode extinguir espécies
Disponível em: http://revistagloborural.globo.com/GloboRural/0,6993,EEC1697314-1641,00.html Acesso em: 02/12/2010.
Em seguida, solicite para que relatem sobre:
1. Do que se trata a reportagem?
2. Tem algum termo na reportagem que despertou curiosidade em vocês?
Professor para dar continuidade nas discussões faça intervenções abordando o conteúdo da aula: conceito de pH e sua importância; e substâncias ácidas, básicas e neutras.
Quer relembrar o assunto?
Leia:
http://pt.wikipedia.org/wiki/PH
Atividade 2: Identificando substâncias ácidas e básicas
Professor sugerimos que as atividades 2 e 3 sejam realizadas no laboratório de Ciências ou Química. Os alunos poderão ser organizados em equipes. Cada equipe deverá ficar em uma bancada e receber os materiais necessários para realização dos experimentos.
Dica: professor dê instruções aos alunos dos cuidados que devem ter no laboratório e ao manejar os materiais dos experimentos.
Materiais:
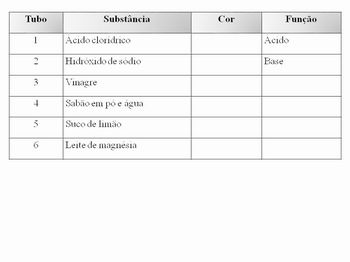
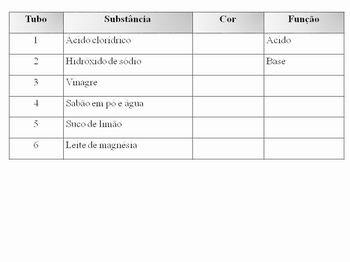
- 3 estantes para tubos de ensaio (A-B-C)
- 18 tubos de ensaio
- 1 vidro conta-gotas para cada solução: fenolftaleína, azul de timol, comprimido de lacto-purga dissolvido em álcool comercial, ácido clorídrico 0,1 mol/L, hidróxido de sódio 0,1 mol/L, sabão em pó e água, leite de magnésia e água
- 1 vidro conta-gotas com vinagre branco puro
Procedimentos:
Teste para ácidos:
Coloque aproximadamente 3 cm de cada substância nos tubos da estante A, na ordem abaixo, e acrescente 3 gotas de azul de timol em cada tubo.
Atenção para as cores:
vermelho - ácido forte
amarelo - ácido fraco
azul - base
Estante A
Teste para bases:
Coloque aproximadamente 3 cm de cada substância nos tubos da estante B, como foi feito no teste acima. Acrescente 3 gotas de fenolftaleína e observe.
Fonte: http://www.pontociencia.org.br/imgdb/experimentos/d9c42708d1c537dca9271fdb820702b7.JPG
Estante B
Teste para indicador:
Coloque novamente 3 cm de cada substância nos tubos da estante C, como nos testes anteriores. Adicione 3 gotas da solução de lacto-purga, em cada tubo. Compare com o teste para bases, que você já fez, e responda:
Que substância deve estar presente no comprimido de lacto-purga?
Fonte: http://www.drogariaeduardo2.com.br/294-342-home/lacto-purga-com-6-comprimidos-hypermarcas-.jpg
Prática adaptada de: http://www.cdcc.sc.usp.br/quimica/experimentos/acidos.html
Atividade 3: O repolho roxo como indicador ácido-base
Indicadores
A propriedade mais notável dos ácidos e bases é a habilidade deles para mudar a cor de certos vegetais. Um bem comum cuja cor responde à aplicação de ácidos e bases é o repolho roxo. O primeiro passo nesta experiência é preparar um extrato de repolho roxo, com o qual você poderá investigar estas mudanças de cores.
Receita
Corte aproximadamente 500 mililitros de repolho roxo em cubos de cerca de 2 cm e coloque num liquidificador ou processador. Acrescente aproximadamente 250 mililitros de água e deixe bater até que o repolho fique cortado uniformemente em pedaços minúsculos. Passe a mistura por uma peneira fina. Esse será nosso extrato de repolho roxo para explorar ácidos e bases.
Fonte: http://www.brasilescola.com/upload/e/indic%20ac%20texto.jpg
1º teste
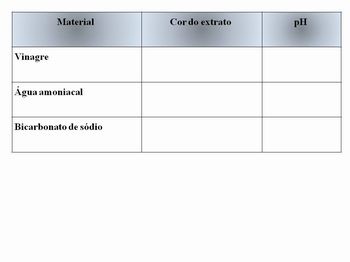
Examine o rótulo de uma garrafa de vinagre branco. O rótulo provavelmente dirá que "contém ácido acético". Isso indica que aquele vinagre é um ácido e tem propriedades de um ácido. Vejamos como este ácido se comporta ao receber nosso extrato de repolho roxo. Coloque 125 mililitros de vinagre em um vidro incolor (copo transparente). Acrescente 5 mililitros (1 colher de chá) de extrato de repolho roxo; mexa bem a mistura e note sua cor. A cor do extrato de repolho com vinagre é a cor que o extrato sempre terá quando misturado com um ácido. Guarde a mistura deste vidro para servir de referência para as próximas experiências.
Fonte: http://www.servmais.com.br/receitas/vinagre_branco_belmont.jpg
*Sugerimos o quadro abaixo para anotar os resultados (deverá ser utilizado nos 3 testes):
2º teste
Coloque 125 mililitros da água amoniacal de lavar roupa em um vidro incolor. Acrescente 5 mililitros do extrato de repolho roxo e mexa bem a mistura. A cor desta nova mistura é: A amônia contida na água de lavar roupa é uma base (substância alcalina). A cor desta mistura é a cor que nosso extrato sempre terá quando misturado com uma base. Guarde este novo frasco para usar sua cor como referência nas próximas experiências. O extrato de repolho roxo, por indicar se uma substância tem as propriedades de um ácido ou de uma base, pode ser chamado de indicador de ácido/base.
3º teste
Para testar as propriedades de um sólido escolhemos o bicarbonato de sódio. Coloque 5 cm3 de bicarbonato de sódio (pó branco usado para acidez estomacal) em um vidro incolor e acrescente 125 mililitros de água. Agite a mistura até que o bicarbonato dissolva totalmente. A seguir, acrescente 5 mililitros de extrato de repolho roxo nesta solução.
Fonte: http://www.nossanoite.com.br/divadomasini/fotos/bicarbonato.jpg
Qual é o pH?
A cor obtida com o bicarbonato de sódio é diferente daquela obtida com o vinagre e também daquela obtida com a amônia. O extrato de repolho pode indicar se uma substância é alcalina (como o caso da água de lavadeira), se é ácida (como é o caso do vinagre). Pode também, pelo tom da cor, mostrar se um ácido ou base é mais forte do que outros.
Os Químicos usam uma escala de pH para expressar quão forte é uma substância ácida ou básica. Um valor de pH abaixo de 7 (sete) indica que a substância é ácida e, quanto menor for o número (6, 5, 4, 3, 2 ...) mais forte será o ácido. Um valor de pH acima de 7 (sete) indica que a substância é alcalina (básica) e, quanto maior for o número (8, 9, 10 ...) mais forte será a substância alcalina.
O extrato de repolho roxo mostrará cores diferentes para valores de pH diferentes. Essas cores e os correspondentes valores (aproximados) de pH são:
Atividade adaptada de: http://www.feiradeciencias.com.br/sala21/21_07.asp
Atividade 4: Curiosidade
Professor no laboratório de informática peça aos alunos que em trios pesquisem sobre o peagâmetro. A pesquisa deve destacar os seguintes itens:
*Onde são utilizados os peagâmetros?
*Qual a sua importância?
*Descreva o funcionamento do peagâmetro de forma sintética.
Fonte: http://3.bp.blogspot.com/_SW7FEBhudqM/S_qZae5RQPI/AAAAAAAAAGk/WWisjuG7ogs/s1600/3.jpg
Sugestão de sites para pesquisa:
http://www.alunosonline.com.br/barra/index.htm?url=http://www.provitec.com.br/sondas/ph.html
http://inorgan221.iq.unesp.br/quimgeral/experimental2/peagametro.html
http://www.splabor.com.br/blog/phmetro/medidor-de-ph-entenda-sua-importancia-para-a-quimica-da-agua/
Recursos Complementares
Avaliação
O processo de avaliação será contínuo. O professor deverá verificar se os alunos estão participando das atividades propostas. Além disso, deve observar se estão conseguindo trabalhar em equipe.
Cinco estrelas 1 classificações
- Cinco estrelas 1/1 - 100%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Rejania, Unopar , Bahia - disse:
deaferroni@hotmail.com31/10/2012
Cinco estrelasAdorei os testes,sao simples e eficazes.parabens.
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus