29/10/2008
José Eduardo Martins
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Física | Calor, ambiente e usos de energia |
O que o aluno poderá aprender com esta aula
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Estratégias e recursos da aula
Estrutura da Aula
Introdução/Motivação (20 minutos)
Para motivar a turma para este aprendizado, o professor pode começar a aula perguntando: como as grandezas pressão, temperatura e volume estão relacionados em um recipiente contendo uma quantidade de gás? O professor pode melhorar esta pergunta, focando nas seguintes questões:
• Quando elevamos a temperatura de um recipiente contendo um gás, qual o efeito sobre a pressão do recipiente?
• Observando o volume do recipiente com gás, o que acontece com este volume quando elevamos a temperatura do sistema?
• Elevando a pressão da caixa com o gás, o que deve acontecer com o volume deste recipiente? O volume deve aumentar ou diminuir?
Para que os estudantes possam compreender o problema que estão tentando resolver, devemos primeiramente, desenvolver juntamente com eles os conceitos de pressão, temperatura e volume.
Desenvolvimento do Conceito de Pressão, Temperatura e Volume (15 minutos)
Pressão:
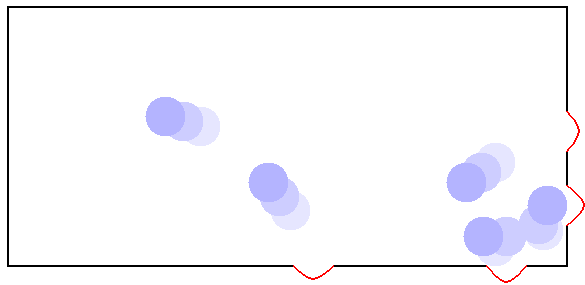
Entre os conceitos pressão, temperatura e volume, o conceito de pressão é o menos intuitivo e o que requer uma definição mais precisa, para não causar interpretações erradas. Dividindo a turma em grupos de 4 alunos (considerando uma turma de 40 alunos), no laboratório de informática, colocaremos cada grupo para acessar o link abaixo.
Acesse a simulação clicando na figura.
Neste exemplo, temos uma simulação computacional que consiste em uma caixa com moléculas se chocando contra suas paredes. Nesta simulação, podemos mostrar a eles que os choques das moléculas, contra as paredes do recipiente, representam a pressão exercida pelo gás. Em linguagem matemática, podemos definir a pressão, como a força exercida pelo gás dividido pela área do recipiente:

Neste momento, o professor deve fazer a seguinte pergunta aos seus estudantes:
• Qual a relação da equação força sobre área com a pressão atmosférica que sentimos?
O professor pode comentar com seus alunos, que a pressão atmosférica também obede ce um mod elo como este. Neste caso, a força em quest&atil de;o é a força de uma coluna de ar que se forma sobre nossas cabeças e a área é a área onde nós estamos. Isso explica o fato de que quando estamos no litoral, onde existem mais partículas sobre nós, a pressão também será maior, se comparado a uma região mais alta.
Temperatura:
Para alunos neste nível de aprendizado, podemos definir a temperatura de um gás, como a medida da agitação das moléculas contidas no recipiente. Esta medida de agitação, quando transportada para o mundo macroscópico apresenta-nos a noção de frio ou quente. Se dissermos que uma porção de um líquido está fria ou quente, em relação a outros materiais, isso significa que as moléculas deste líquido estão em um estado de extrema ou baixa agitação.
Relações entre pressão, temperatura e volume (15 minutos)
Lei de Boyle-Mariotte, relação entre pressão e volume:
Essa lei foi enunciada independentemente por Robert Boyle e Edme Mariotte. A lei de Boyle-Mariotte, diz que para um recipiente com gás à temperatura constante, o produto do volume deste gás pela sua pressão é constante. Desta forma, a pressão e o volume deste gás são inversamente proporcionais, quando um aumenta o outro diminui.
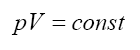
Lei de Gay-Lussac, relação entre volume e temperatura:
Em um recipiente contendo um gás a pressão constante, ou seja, com volume variável o volume deste gás e sua temperatura são diretamente proporcionais. Quando elevamos a temperatura do gás s eu volume também aumenta. A lei de Gay-Lussac pode ser expressa na linguagem matemática como
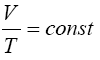
A constante desta relação pode ser encontrada através do gráfico do volume em função da temperatura, que nos dá uma reta onde a tangente do ângulo de inclinação será o termo constante desta equação.
Lei de Charles, relação entre pressão e temperatura:
Uma última relação que temos entre estas três grandezas que descrevem o estado de um gás é dada pela lei de Charles. Dado um gás a volume fixo, dentro de uma caixa lacrada, a lei de Ch arles estabelece que ne sta condição quando aumentamos ou diminuímos a temperatura do recipiente a pressão interna deste sistema também deve aumentar ou diminuir. O comportamento da dependência da temperatura em relação à pressão também é similar, quando aumentamos ou diminuímos a pressão do gás, sua temperatura também deve aumentar ou diminuir. Este comportamento pode ser expresso em termos da seguinte equação matemática
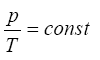
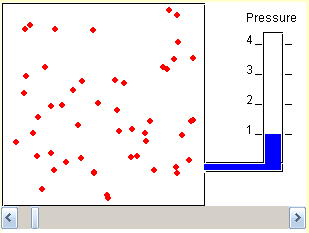
Para que os estudantes possam visualizar como ocorre esta relação entre pressão e temperatura na lei de Charles, vamos apresentar a eles a seguinte simulação:colocar
Acesse a simulação clicando na figura.
Nesta simulação, os estudantes poderão ver como em uma transformação isométrica a pressão está relacionada com a temperatura. Se aumentarmos a temperatura da caixa com as partículas, sua pressão deve aumentar e se a diminuirmos a pressão também deve diminuir como prevê a lei de Charles.
Recursos Complementares
Avaliação
Cinco estrelas 1 classificações
- Cinco estrelas 1/1 - 100%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Monica, UFPB , Paraíba - disse:
irissoares_jp@hotmail.com17/10/2010
Cinco estrelasFoi jóia me ajudou bastante!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus