06/06/2011

|

|

|

|

|

|

|

|
Luciane Mara Cardoso Freitas
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
O que o aluno poderá aprender com esta aula
-
Identificar as transformações gasosas (isotérmica, isobárica e isovolumétrica);
-
Relacionar as transformações gasosas com as leis de Boyle, Charles e Charles/Gay-Lussac;
-
Verificar o comportamento da pressão e da energia cinética média das moléculas quando a temperatura, o volume e o número de moléculas variam de acordo com a equação geral dos gases perfeitos;
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Para uma melhor compreensão e desenvolvimento desta aula é importante que o aluno tenha conhecimento sobre: características dos gases ideais, teoria cinética dos gases, variáveis de estado dos gases (temperatura, pressão e volume), número de mols de um gás.
Estratégias e recursos da aula
ATIVIDADE 1/AMBIENTE 1:
Laboratório de informática
PREPARAÇÃO DO AMBIENTE:
Serão necessários para a realização desta atividade: lápis ou caneta, papel (qualquer tipo) e um computador com acesso à internet para que os alunos possam explorar o site http://www.facil.webs.com/gases/gases_transf.htm
ORIENTAÇÕES QUANTO AO USO DO OBJETO EDUCACIONAL:
Esta atividade será baseada na exploração do site http://www.facil.webs.com/gases/gases_transf.htm o qual apresenta um mini aplicativo Java. Desta forma, é necessário que o computador tenha acesso à internet e que apresente o software Java instalado. O download deste software poderá ser realizado através do seguinte endereço: http://www.java.com/pt_BR/download/
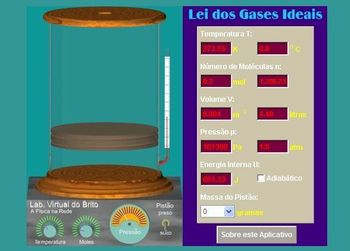
Figura 1- Mini aplicativo Java
Imagem disponível em: http://www.facil.webs.com/gases/gases_transf.htm (Acesso: 02/06/2011)
DESCRIÇÃO DA ATIVIDADE:
Nesta atividade, os alunos explorarão o site http://www.facil.webs.com/gases/gases_transf.htm
Através do Mini aplicativo Java do site (ver figura 1), a atividade será realizada seguindo as etapas abaixo:
1ª etapa-Lei de Charles
O aluno anotará os valores de cada variável do primeiro aplicativo da sequência de três apresentadas no site. Em seguida, o aluno deve girar o botão da temperatura (arrastando a seta no sentido horário) até atingir 100ºC. Feito isso, o aluno irá comparar os dados anotados anteriormente com os atuais. E então, ele irá relacionar o observado com a lei de Charles.
2ª etapa-Lei de Charles e Gay-Lussac
O aluno deverá anotar os valores da situação anterior, ajustar a temperatura do segundo aplicativo para 0ºC girando o botão da temperatura no sentido anti-horário, arrastar a chave do pistão (localizada no canto inferior esquerdo do aparelho medidor) para cima na posição preso e observar o que acontece com as variáveis. Ele deve relacionar sua conclusão com a lei de Charles/ Gay-Lussac descrita no site.
3ª etapa-Lei de Boyle
Novamente o aluno deve fazer as anotações dos valores das variáveis da 2ª etapa, ajustar a temperatura para 0ºC do terceiro aplicativo da sequência e certificar-se de que o número de moles continua em 0,2. Em seguida, ele deve clicar no pistão e arrastá-lo observando aumento de pressão para 3 atm. Depois disso, o aluno deve analisar o que aconteceu, comparar os dados e relacionar sua conclusão com a lei de Boyle.
Observação: As informações que orientam a utilização do instrumento medidor (Mini aplicativo Java) descritas nesta atividade são as mesmas do site, entretanto estão adaptadas a esta aula. Vale ressaltar que é apresentada claramente, no fim da página do site, a seguinte informação “Este material educacional foi elaborado por José Brito e seu uso é livre”.
MOMENTO DO ALUNO:
Neste momento, os alunos irão explorar o site seguindo as orientações do campo “Descrição da atividade”. Os alunos poderão sentir alguma dificuldade em entender como a posição do êmbolo (preso ou solto) influi no sistema. Para ajudá-los, o professor poderá fazer alguns questionamentos, tais como: Ao deixar êmbolo solto, o que acontece com a pressão quanto se altera a temperatura? Quando se prende o êmbolo, o que acontece com a pressão?
DISCUSSÃO:
Os alunos irão apresentar suas conclusões a respeito das transformações gasosas vistas durante a exploração do site. Em seguida, o professor poderá propor um debate entre os alunos a partir do seguinte questionamento: Como podemos explicar a lei de Boyle em nossos pulmões durante a inspiração e a expiração?
SISTEMATIZAÇÃO:
Este será o momento da formalização do conteúdo desta atividade, recomenda-se que o professor construa uma tabela no quadro ou em cartazes como mostra abaixo. As partes que se encontram em destaque (em amarelo), o professor deverá deixar em branco e reproduzir em papéis com letras grandes, em seguida, entregar aos alunos de forma aleatória. Os alunos deverão completar a tabela pregando as palavras com fita adesiva.
| Variáveis |
Transformação Isobárica |
Transformação Isocórica |
Transformação Isotérmica |
| Pressão |
Constante |
Aumenta/ Diminui |
Aumenta/Diminui |
| Volume |
Aumenta/ Diminui |
Constante |
Diminui/Aumenta |
| Temperatura |
Aumenta/Diminui |
Aumenta/Diminui |
Constante |
| Proporcionalidade entre as variáveis |
VαT |
PαT |
Pα1/T
|
Tabela 1
Após isso, é interessante que o professor enuncie as três leis das transformações gasosas e comente sobre a lei de Boyle em nossos pulmões ilustrando com a seguinte figura:
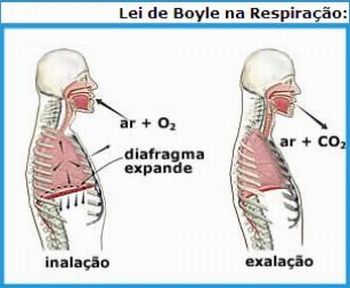
Figura 2
Imagem disponível em: http://www.qmc.ufsc.br/quimica/pages/aulas/gas_page2.html (Acesso: 25/02/2011)
Observação: Autores de sites e de livros não acordaram entre si a autoria das leis que regem as transformações gasosas, portanto a autoria destas leis adotada nesta aula será de acordo com João Usberco e Edgard Salvador.
ATIVIDADE 2/AMBIENTE 1:
Laboratório de informática
PREPARAÇÃO DO AMBIENTE:
Nesta atividade será utilizado o computador, com acesso a um objeto educacional denominado Pressão de um gás-Nova versão , lápis e papel.
ORIENTAÇÕES QUANTO AO USO DO OBJETO EDUCACIONAL:
O objeto Pressão de um gás-Nova versão pode deve ser acessado em computadores, com internet disponível, através do site http://www.molecularium.net/pt/pressao/index.html (Figura 3)
Entretanto, no canto inferior esquerdo da figura 3, há um link indicando a versão para download. Está escrito da seguinte forma: “Versão offline: pressão.zip”. Ao clicar nesse link, haverá uma pasta de arquivos denominada “pressão”. O usuário deve abri-la e clicar em outra pasta denominada “index.html”, essa pasta dará acesso ao software. Para visualizá-lo, é necessário ter o software Adobe Flash Player que está disponível para download no site http://get.adobe.com/br/flashplayer/ , além do navegador Mozilla Firefox.
Observação: Apesar da versão para download precisar do navegador Mozilla Firefox para sua visualização, o computador não necessita ter acesso à internet.
Ao acessar o site, aparecerá a seguinte imagem:
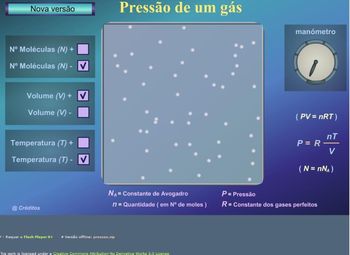
Figura 3
Imagem disponível em: http://www.molecularium.net/pt/pressao/index.html
Tanto a versão para download, quanto a online iniciam-se como mostra a figura 3. Entretanto, para esta aula recomenda-se que, ao iniciar o aplicativo, o usuário clique no ícone “Nova Versão”, como indica a figura 3 no canto superior esquerdo.
DESCRIÇÃO DA ATIVIDADE:
Nesta atividade, os alunos irão utilizar o software Pressão de um gás-Nova versão . O aluno irá utilizar o aplicativo do objeto (Figura 4) seguindo as orientações propostas em uma tabela do “Roteiro interactivo” do objeto (Figura 5). Na tabela, há 8 situações para que o aluno possa seguir modificando as variáveis da sessão D da figura 4.
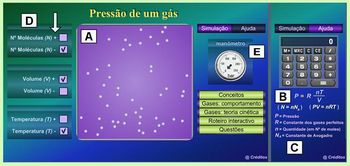
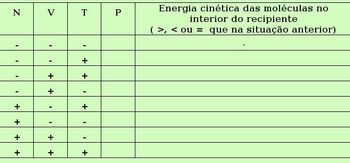
Figura 4 Figura 5
Imagens (das figuras 4 e 5) disponíveis em:
http://www.molecularium.net/pt/pressao/n/dados/roteiro/index.html
Relacionando a tabela da figura 5 com o aplicativo do objeto (Figura 4), o aluno fará a atividade como mostra abaixo:
Na primeira situação (Figura 5), onde as variáveis apresentam-se da seguinte forma: N(-), V(-) e T(-), o aluno deve clicar nos quadrados de cor lilás (sessão D, figura 4) com sinal de (-) para todas as variáveis. Em seguida, ele irá anotar na tabela acima o valor da pressão indicada no manômetro localizado na sessão E, figura 4. Na segunda situação, ele deve modificar a temperatura (como mostra a tabela), anotar a pressão e comparar a energia cinética média das moléculas do interior do recipiente com a energia da situação anterior através do movimento das moléculas. Assim o aluno irá seguir as orientações de cada situação mostrada, anotando sempre o valor da pressão e comparando com a situação imediatamente anterior. Deste modo, os alunos irão avaliar como a temperatura, o número de moléculas e o volume irão influir na pressão do gás.
MOMENTO DO ALUNO:
Este será o momento em que os alunos realizarão a atividade proposta. Poderão surgir dúvidas dos alunos em verificar a energia cinética das moléculas do interior do recipiente. Para ajudá-los, o professor poderá fazer alguns questionamentos, tais como: Qual a variável que atua na energia cinética?Observando o movimento das moléculas do gás, o que pode ser diretamente proporcional à energia cinética das moléculas?
DISCUSSÃO:
Os alunos terão agora que exibir suas respostas e apresentar suas conclusões da utilização do software. Em seguida, os alunos deverão discutir entre si a relação entre o que observaram e a equação geral dos gases perfeitos. O professor poderá propor alguns questionamentos aos alunos para que possa originar um debate, por exemplo: Mantendo-se a mesma quantidade de moléculas e a temperatura constante, será que um aumento de volume provoca um aumento de pressão (sim ou não)? como se explica microscopicamente? Nas latas de aerossóis é frequente aparecerem avisos de segurança, que referem: não expor a temperaturas superiores a 50 ºC. Porque não se podem expor essas latas a temperaturas elevadas?
Observação: Os questionamentos propostos acima foram extraídos do “Roteiro Interativo” do objeto educacional.
SISTEMATIZAÇÃO:
Neste momento, sugere-se que o professor apresente o que ocorre, de fato, em cada situação da figura 3 da seguinte forma:
Na 1ª situação, considerada como referência para a segunda, tivemos uma pressão de aproximadamente 35 bar. Na 2ª, com o aumento da temperatura, observa-se que a pressão aumenta para 100 bar e, consequentemente, a energia cinética média das moléculas também aumenta. Na 3ª situação, tivemos um aumento de volume, a pressão diminuiu para aproximadamente 40 bar e a energia cinética permaneceu a mesma da situação anterior, pois a temperatura não se modificou. Na 4ª, com a diminuição da temperatura, a pressão diminuiu novamente, assim como a energia cinética das moléculas. A 5ª situação caracterizou-se com o aumento da temperatura, aumento do número de moléculas e diminuição do volume. Pôde-se verificar que a pressão aumentou para 250 bar e a energia cinética também sofreu um aumento. Na 6ª, com a diminuição da temperatura, a pressão diminuiu, assim como a energia cinética. Na penúltima situação, aumentou-se o volume, então a pressão diminuiu, mas como a temperatura permaneceu inalterada, a energia cinética também não se modificou. Na última situação, tivemos um aumento da temperatura, por consequência, a pressão e a energia cinética tiveram um aumento em seus valores.
Entretanto, a cada situação que o professor explicar, um aluno poderá anunciar para a turma a relação existente entre a situação proposta e a equação geral dos gases perfeitos:
Desta forma, se algum dos alunos explicarem de forma incompleta, o professor deverá pedir para que outro complemente e assim por diante.
ATIVIDADE 3/AMBIENTE 1:
Laboratório de informática
PREPARAÇÃO DO AMBIENTE:
Nesta atividade, será usado o computador com acesso ao vídeo Transformações gasosas disponível em: http://www.youtube.com/watch?v=8IYLWBp2Bbo. Recomenda-se que o professor combine com os alunos que a atividade será feita em 12 grupos.
DESCRIÇÃO DA ATIVIDADE:
Inicialmente, o professor dividirá a turma em 12 grupos. Esses grupos analisarão quatro situações que estão descritas no vídeo http://www.youtube.com/watch?v=8IYLWBp2Bbo
Os grupos analisarão se a pressão, a temperatura e o volume (do ar de dentro dos objetos) irão variar ou permanecer constante em cada situação, dessa forma cada grupo será responsável por uma variável. Por exemplo, o grupo 1 analisará se a pressão na situação 1 irá variar ou permanecer constante. Já o grupo 2, fica com a temperatura e assim por diante. As situações descritas no vídeo são as seguintes:
-
Uma panela de pressão bem fechada, inclusive a válvula de escape, em aquecimento;
-
Uma bomba de bicicleta, com o orifício vedado, tendo o seu êmbolo pressionado rapidamente;
-
Uma sacola de supermercado com um pouco de ar preso fechada com fita adesiva. Esta sacola está sendo exposta ao sol com um pequeno peso segurando-a.
-
Uma bomba de bicicleta, com o orifício vedado, tendo seu êmbolo pressionado vagarosamente.
Obs. Os alunos terão que dizer também quais as transformações gasosas que estão acontecendo em cada situação dada.
MOMENTO DO ALUNO:
Este será o momento em que os alunos analisarão as situações propostas. Eles poderão ter dificuldades em relação comportamento das moléculas de ar dentro dos objetos em cada uma das situações apresentadas. O professor poderá propor alguns questionamentos para ajudar os alunos, tais como:
Situação I: Com a influência do fogo da panela, a velocidade das moléculas irá aumentar ou diminuir?
Situação II: Ao serem empurradas pelo êmbolo, as moléculas vão ganhando energia, então a velocidade delas vai aumentar ou diminuir?
Situação III: O aquecimento da sacola pelo sol provocará mudança na velocidade das moléculas?
Situação IV: Como o êmbolo está sendo pressionado vagarosamente, o ar recebe energia dele, que empurra suas moléculas, mas ela é dissipada. Mesmo desta forma, a velocidade das moléculas se altera?
DISCUSSÃO:
Este será o momento em que os alunos irão expor suas conclusões. Como cada grupo está responsável por uma variável e as variações são interdependentes, então os alunos irão discutir se a pressão, o volume e a temperatura sofreram a variação correta de acordo com a explicação de cada um. Por exemplo, um aluno poderá colocar que a pressão da situação 1 diminui durante o processo, a que se deve este fato? Para cada hipótese criada, o aluno terá que justificar porque a variável aumentou ou diminuiu.
SISTEMATIZAÇÃO:
Neste momento, recomenda-se que o professor sistematize com os alunos a influência das variações de pressão, temperatura e volume nas quatro situações propostas. Sugere-se então que o professor divida os alunos em duplas e forneça uma frase (ver tabela 2) para cada dupla, entretanto estas frases não devem estar enumeradas, pois os alunos ficarão responsáveis em colocá-las em suas devidas ordens. As frases deverão estar disponíveis para os alunos em papéis (ofício ou cartolina) com letras grandes para que eles possam pregá-las no quadro. É importante que o professor informe aos alunos quantas etapas há em cada experimento.
| Experimento 1 |
|
| Experimento 2 |
|
| Experimento 3 |
|
| Experimento 4 |
|
Tabela 2
No final, o professor poderá fornecer aos alunos, de forma oral, a ordem correta e então alguns alunos poderão colocá-las em ordem no quadro.
Observação: Essas frases foram extraídas do vídeo: http://www.youtube.com/watch?v=YWNPIvbKfp0&NR=1 (Acesso: 15/02/2011)
Recursos Complementares
-
Lei de Boyle-Mariotte ( http://www.stefanelli.eng.br/webpage/p_boyle.html ): Nesta página da internet tem-se uma demonstração da lei de Boyle-Marriote e alguns questionamentos relacionados à mesma.
-
Lei de Gay-Lussac (http://www.stefanelli.eng.br/webpage/p_gay_lc.html ): Este site contém a definição da lei de Gay-Lussac e uma explicação prática a partir de uma animação.
-
O estado gasoso ( http://www.qmc.ufsc.br/quimica/pages/aulas/gas_page2.html ): Neste site há explicações das leis de Boyle, Charles e de Avogrado.
Avaliação
A avaliação deverá ser realizada no decorrer das atividades, principalmente durante as discussões, momento em que os alunos apresentarão suas conclusões acerca do conteúdo desenvolvido. Na atividade 1, o professor poderá verificar se os alunos conseguiram entender as transformações gasosas através das leis de Boyle, Charles e Charles/Gay-Lussac. Na atividade 2, sugere-se que o professor averigue se os alunos conseguiram estabelecer as relações que o volume, a temperatura e o número de moléculas possuem com a pressão do gás e a energia cinética média das moléculas. Na atividade 3, recomenda-se que o professor identifique se os alunos conseguiram entender a influência que as variáveis de estado dos gases tem umas com as outras em casos práticos através de experiências do cotidiano.
Duas estrelas 1 classificações
- Cinco estrelas 0/1 - 0%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 1/1 - 100%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
wedja Daiane Ramos, Universidade Federal de Alagoas , Alagoas - disse:
wedjaramos87@hotmail.com16/06/2011
Duas estrelasGostei da aula, mas ainda ficou um pouco incoerente....
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus

