04/08/2009
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
O que o aluno poderá aprender com esta aula
Comparar a acidez de materiais de seu cotidiano.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Conceitos de ácidos e bases.
Soluções (conceito e formas de expressar concentração em quantidade de matéria - "mol/litro")
Estratégias e recursos da aula
Primeiro momento (laboratório de informática)
Inicialmente, discuta com os alunos as seguintes frases:
"Osso de galinha fica mole após mergulhado em um copo de refrigerante?";
"Temos ácido no estômago."
Comente com os alunos: "Essas observações por vezes assustam, não?"
Mostre uma ou mais contas de água (seria interessante que os alunos trouxessem outras de diferentes meses). Peça que localizem a análise da água. Qual o valor registrado para o pH da água. Ele foi igual em cada mês? É importante observarmos o pH da água?
Pergunte aos alunos se já ouviram falar de pH em outros situações. É possível que tenham ouvido ou lido sobre pH da água da piscina, pH do solo, pH da chuva ou de outros materiais. "Mas o que significa pH"?
Mostre aos alunos como fica o papel indicador universal ou outro indicador de pH testando em alguns líquidos disponíveis (água, alguma solução ácida como o vinagre e outra alcalina como o sabão dissolvido em água). Peça para lerem os resultados comparando as cores com os padrões que vêm na caixa do papel:

Pergunte-lhes qual seria a explicação para tantas cores para um papel indicador.
Numa primeira aproximação de conceitos, apresente-lhes as seguintes ideias:
_________________________
A escala de pH nos indica quão ácida ou alcalina é uma solução.
Se tivéssemos água puríssima (ou qualquer solução aquosa neutra), dependendo da temperatura, haveria cerca de 1,0.10-7 mol de íons hidrônio (H3O1+) por litro e uma quantidade igual de íons hidroxila (OH1-). Esses íons aparecem devido a uma pequena ionização da água:
H2O + H2O -> OH1- + H3O1+
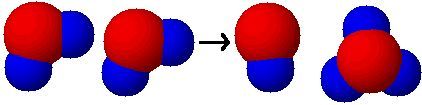
Mas como podemos comparar se um material é mais ácido do que outro?
Como frequentemente essas concentrações apresentam valores muito pequenos, é inconveniente trabalhar com eles. Em 1909, o químico dinamarquês S.P.L. Sørensen propôs que somente o número do expoente seria empregado para expressar a acidez.
Assim, segundo essa proposta, uma solução com 1,0.10-7 mol/l de íons hidrônio tem pH 7; uma solução com 1,0.10-3 mol/l de íons hidrônio tem pH 3.
Retome os padrões do papel indicador e mostre-lhes que cada combinação de cor corresponde a um pH, que nada mais é do que uma forma mais prática de expressar a concentração de íons hidrônio numa solução. É mais fácil falarmos em "pH 7" do que "concentração hidrogeniônica 1,0.10-7 mol/l", não é verdade?
Com essa escala, pode mos ter ideia de quem é ma is ácido d o que quem ou, ao contr ário, quem é mais alcalino do que quem.
Para compreender melhor como se comportam diferentes líquidos, leve os alunos a usarem o simulador de Escala de pH:
_________________________
Segundo momento (laboratório de informática)
No laboratório de informática, os alunos poderão simular como varia a concentração dos íons hidrônio e oxidrila em soluções conhecidas, identificando-as como ácidas ou alcalinas.
Peça aos alunos seguirem os seguintes passos:
1) Acesse o endereço http://phet.colorado.edu/simulations/sims.php?sim=pH_Scale
Há versão em português aqui: http://phet.colorado.edu/sims/ph-scale/ph-scale_pt_BR.jnlp (on line)
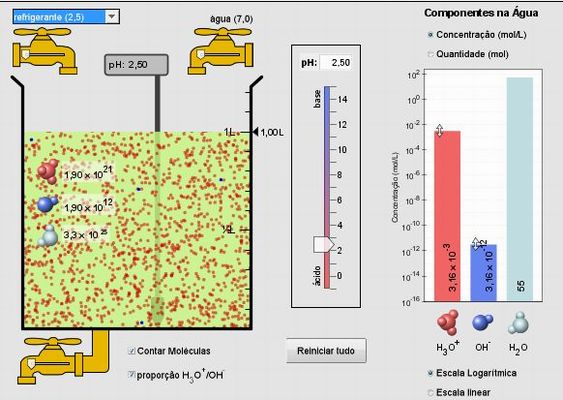
2) Explore o programa, escolhendo os diferentes líqu idos disponíveis (leite, sangue, refrigerante, etc.)
3) Marque as opções "Contar Moléculas" e "proporção H3O1+/OH1-".
Questões
1) Qual o pH mostrado para cada solução?
2) O que acontece com a concen tração de íons H3O1+ quando o valor do pH diminui? (Dica: Observe no gráfico à direita da janela do programa)
3) O que acontece com a concentração de íons OH1- quando o valor do pH diminui? (Dica: Observe no gráfico à direita da janela do programa)
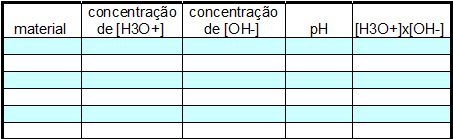
4) Anote em uma tabela alguns dos resultados obtidos com o simulador. Calcule o valor de [H3O1+] vezes [OH1-].
Veja exemplo:
5) O que é mais ácido: um líquido com pH 3 ou um líquido com pH 8? Por quê?
6) Dizer que o ácido da bateria tem pH 1,0 significa dizer que ele é duas vezes e meia mais ácido que o refrigerante (que tem pH 2,5)?
7) Dizer que o refrigerante tem pH 2,5 significa dizer que ele é duas vezes mais ácido que o café (que tem pH 5)?
8) Você beberia um copo de leite que tivesse pH 4,5? Por quê?
Enquanto respondem as questões, peça aos alunos para abrirem o simulador "Água bem tratada" (http://portaldoprofessor.mec.gov.br/fichaTecnica.html?id=17329). Informe os alunos que esse simulador trata dos conceitos vistos até agora numa situação comum.

9) Em que exemplos de situações do cotidiano seria importante observar o pH além da água da piscina? Discuta sua resposta com seus colegas.
Comentários para o professor
Caso não disponha de papel indicador (por vezes, caro ), pode-se recorrer a imagens disp oníveis na internet (se possível, imprima em cores os padrõe s para mostrar a ideia) ou mesmo mostrar algum estojo já usado.
Em vez de cada aluno acessar a internet (passo 1 do segundo momento), pode-se in stalar previamente o simulador em cada computador copiando o arquivo disponíve l em http://phet.colorado.edu /admin/get-run-offline.php?sim_id=225&locale=pt_ BR
A atividade é simples na simulação, no entanto, sua compreensão é mais complicada por envolver valores muito pequenos de concentração.
Especial atenção às ques tõ es 6 e 7: Um pH 2,5 vezes maior significa na verdade uma concentração de hidrônio102,5 vezes maior (concentração cerca de 316 vezes maior)! Isso porque para cada unidade de pH menor, a concentração de hidrônio aumenta 10 vezes. Uma solução com pH 3 possui 10 vezes mais hidrônios livres do que uma solução de pH 4.
A questão 9 é abrangente, podendo levar os alunos a considerar diversos aspectos possíveis e válidos:
a) O pH da água mais próximo de 1 ou de 14 indicaria presença de outras substâncias que poderiam torná-la não-potável.
b) Valores inadequados de pH em sabonetes e xampus podem causar irritação na pele de pessoas sensíveis.
c) Valores fora de determinados padrões em alimentos podem indicar que estão estragados (vencidos) ou foram contaminados.
No passo 4, os alunos podem usar uma calculadora científica (pode ser do computador). Também é possível fazer os cálculos na ponta do lápis, uma oportunidade para rever conceitos matemáticos básicos.
Outro recurso seria usar planilha eletrônica para preencherem com os dados e fazerem os cálculos. O uso da planilha eletrônica permitiria também que os alunos criassem um gráfico de barras das concentração de [H3O1+].
Um exemplo de planilha preenchida e com gráfico gerado está disponível em http://khemis.vilabol.uol.com.br/gd.htm.
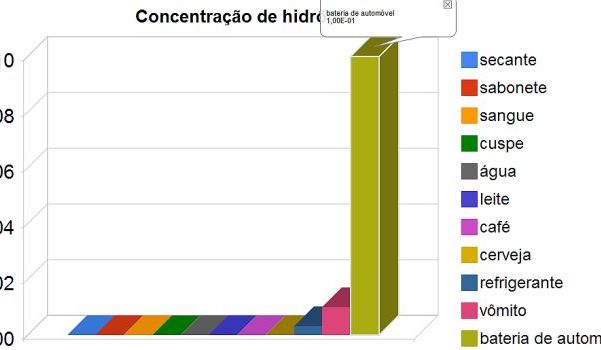
O gráfico é uma forma de mostrar como o líquido da bateria de automóvel tem concentração de hidrônio muito maior que o vômito e os demais líquidos. O pH 1 na bateria significa uma concentração dez vezes maior de hidrônio do que no vômito (pH = 2) e assim por diante.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Água bem tratada | Animação/simulação |
Recursos Complementares
GoogleDocs: http://docs.google.com (exemplo em http://khemis.vilabol.uol.com.br/gd.htm)
Avaliação
Avaliar as respostas às questões propostas, considerando participação na atividade proposta.
Sem estrelas 0 classificações
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncie opiniões ou materiais indevidos!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus



