20/08/2009
Marco G. B. Burlamaqui
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
O que o aluno poderá aprender com esta aula
- Calcular a voltagem gerada por uma célula eletrolítica;
- Conceituar o potencial padrão de redução;
- Comparar o valor do potencial padrão de redução de algumas substâncias: magnésio, cobre, zinco e outras.
- Utilizar o potencial padrão de redução para prever a oxidação ou a redução de algumas substâncias.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
- Modelo atômico;
- Conceito de oxidação e redução.
Estratégias e recursos da aula

- Professor, providencie uma solução de sulfato de cobre penta hidratado (CuSO4.5H2O), um prego, um pedaço de palha de aço e um pedaço de fio de cobre.
- Professor, salve nos computadores os endereços das simulações que serão utilizadas ao longo da aula.


Aula 01:
Inicie a aula mostrando para os alunos a solução de sulfato de cobre penta hidratado (CuSO4.5H2O) que foi previamente preparada. Em seguida, pegue o prego e lixe-o com a palha de aço. Mergulhe o prego na solução. Peça para que os alunos observem o que acontece. Os alunos deverão comparar o novo aspecto do prego com o fio de cobre.
Informe aos alunos que esse fenômeno pode ser explicado através das teorias da eletroquímica, que consiste na geração de energia elétrica através de reações químicas.
Após isso, leve os alunos para o laboratório de informática da escola.


No laboratório de informática, divida os alunos em grupos de três ou quatro alunos. Em seguida, peça para que os alunos abram a simulação abaixo:
A pilha de Daniel
http://portaldoprofessor.mec.gov.br/fichaTecnica.html?id=18002

Figura 1 – Imagem retirada do próprio recurso
Nessa simulação os alunos poderão verificar a geração de energia elétrica através das reações de oxidação e de redução de algumas substâncias químicas. Eles poderão selecionar duas substâncias observar qual a voltagem gerada por elas.
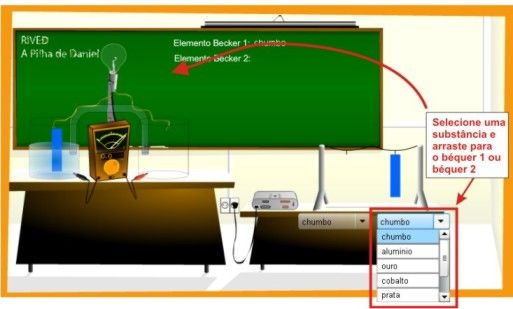
Figura 2 – Instruções da simulação
Peça para que os alunos pesquisem na internet sobre as substâncias que constituem a Pilha de Daniell. Os alunos encontrarão que a Pilha de Daniell (também chamada de Célula de Daniell) é constituída por dois eletrodos: um de zinco (Zn) e um de cobre (Cu). Os alunos deverão reproduzir a Pilha de Daniell utilizando a simulação, para isso, eles deverão selecionar o zinco e o cobre, e colocá-los no béquer 1 e no béquer 2, respectivamente. Pergunte aos alunos qual foi a voltagem gerada por essa pilha? Os alunos responderão que foi de 1,1 V. Os alunos deverão construir uma tabela para anotarem a voltagem gerada pelos diferentes eletrodos:
| Eletrodo 1 | Eletrodo 2 | Voltagem gerada (V) |
| Zinco | Cobre | 1,1 |
| Zinco | Chumbo | 0,02 |
| Zinco | Alumínio | 0,2 |
Diga para que os alunos anotem a voltagem de da combinação de todos os eletrodos.
Aula 02:
Em seguida, pergunte aos alunos por que quando mudamos os eletrodos a voltagem gerada muda? É provável que os alunos não saibam a resposta, sendo assim, explique que a voltagem gerada por cada célula eletrolítica está relacionada com o potencial padrão de redução (E) de cada um dos eletrodos. Esse potencial define qual das espécies vai reduzir, ganhar elétrons, e qual das espécies vai oxidar, perder elétrons, ou seja, o cobre possui o potencial padrão de redução maior do que o zinco, por isso, o cobre reduz e o zinco oxida:
Zn2+ + 2e- → Zn E = -0,76 V (o zinco irá oxidar, e o seu E0 = 0,76 V)
Cu2+ + 2e- → Cu E = 0,36 V
Somando os valores do potencial padrão de redução da espécie que oxida e da espécie que reduz teremos:
0,76 V + 0,34 V = 1,1 V
Obs.: Professor, aproveite esse momento para revisar os conceitos de oxidação e redução.
Utilizando a tabela abaixo peça para que os alunos calculem a voltagem gerada pela combinação dos diferentes eletrodos descritos na tabela 1.
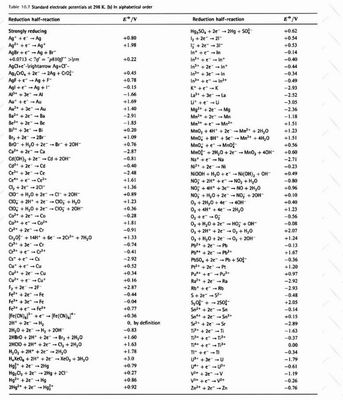
Figura 3 – Tabela do potencial padrão de redução de algumas substâncias
Fonte:
http://proquimica.iqm.unicamp.br/10_7.htm - acessado em 03 de agosto de 2009
Obs.: Professor, se preferir, utilize as tabelas do livro didático que utiliza em sala de aula.
Os alunos poderão organizar os dados utilizando uma tabela, como exemplificado abaixo:
| Eletrodo 1/E0 (V) | Eletrodo 2/E (V) | Voltagem gerada (V) |
| Zinco (Zn)/-0,76 | Cobre(Cu)/0,36 | 1,1 |
Depois de construída a tabela 2 os alunos poderão comparar os valores da voltagem com os valores da tabela 1. Peça para que os alunos façam o cálculo da voltagem em uma folha, de forma organizada, pois esses cálculos serão avaliados.

Para sistematizar a aula os alunos deverão fazer um relatório sobre o que eles entenderam do tema abordado na aula, explicando como funciona a simulação utilizada. Além disso, peça para que os alunos calculem a voltagem para cada uma das células eletrolíticas apresentadas na simulação abaixo, para isso, deverão utilizar a figura 3 que contém o potencial padrão de redução para algumas substâncias:
Medição de potenciais em relação ao magnésio
http://portaldoprofessor.mec.gov.br/fichaTecnica.html?id=17918
 Medição de potenciais em relação ao magnésio
Medição de potenciais em relação ao magnésio
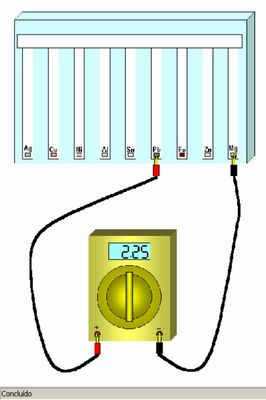

Caso o professor não tenha à sua disposição um laboratório computacional e possua apenas um computador com um datashow, poderá mostrar as simulações e as imagens aos alunos na própria sala de aula.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Medição de potenciais em relação ao magnésio | Animação/simulação |
| A pilha de Daniel | Animação/simulação |
Recursos Complementares
Simulação
O troféu de alumínio
Uma simulação que trabalha de forma bem simplificada conceitos como: célula eletrolítica e reações oxi/red.http://portaldoprofessor.mec.gov.br/fichaTecnica.html?id=13698
Para o Professor:
Caso queira continuar trabalhando com os conceitos sobre Eletroquímica acesse a aula a seguir: O Bafômetro e o Número de Oxidação.
http://portaldoprofessor.mec.gov.br/fichaTecnicaAula.html?aula=273
Avaliação
Sem estrelas 0 classificações
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncie opiniões ou materiais indevidos!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


