08/11/2012

|

|

|

|

|

|

|

|

|

|

|

|
Shara Macedo Fontenelle Teixeira
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Água |
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
O que o aluno poderá aprender com esta aula
·Definir solubilidade;
·Diferenciar soluto, solvente e solução;
·Compreender soluções diluídas, concentradas, saturadas e supersaturadas;
·Analisar a curva de solubilidade de um material;
·Conhecer aplicações deste conteúdo curricular em situações cotidianas e em um processo de investigação criminal.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
·Conhecimento básico sobre dissociação iônica.
Estratégias e recursos da aula
ATIVIDADE 1 – O QUE É SOLUBILIDADE?
PREPARAÇÃO DO AMBIENTE
Esta atividade será desenvolvida no laboratório de informática educativa (LIE) e será necessária a disponibilização de computadores que tenham acesso à internet. O docente irá acordar com os alunos as seguintes regras:
· Organização da turma em cinco grupos;
· Participação ativa nas atividades.
ORIENTAÇÕES QUANTO AO USO DO OBJETO EDUCACIONAL
Os vídeos a serem utilizados nessa atividade estão disponíveis para download no Banco Internacional de Objetos Educacionais, segue uma pequena descrição e o respectivo link de cada objeto educacional:
1. O primeiro vídeo (ver figura 1) é denominado Aí tem química! Solubilidade I (duração de aproximadamente 10 minutos) e apresenta tópicos sobre solubilidade, abrangendo, por exemplo, misturas homogêneas,tipos de solução, solutos e solventes e a influência da temperatura. Este recurso está disponível para download no endereço eletrônico http://objetoseducacionais2.mec.gov.br/handle/mec/12045.
Figura 1 - vídeo Solubilidade I, explicando sobre soluto, solventes e soluções

Fonte: http://objetoseducacionais2.mec.gov.br/handle/mec/12045
2. O segundo recurso (ver figura 2) é denominado Aí tem química! Solubilidade II (duração de aproximadamente 11 minutos), apresenta os tipos de soluções, trazendo um exemplo específico para a solução tipo sólido-sólido, e comenta como a pressão pode influenciar a interação do soluto-solvente. Este recurso está disponível para download no endereço eletrônico http://objetoseducacionais2.mec.gov.br/handle/mec/12046.
Figura 2 - Vídeo Solubilidade II, explicando sobre as soluções no sólido-sólido.

Fonte: http://objetoseducacionais2.mec.gov.br/handle/mec/12046
Para que a exibição destes vídeos seja possível, é necessário que o computador tenha o programa Flash Player instalado, este se encontra disponível no seguinte endereço eletrônico: http://www.adobe.com/br/products/flashplayer/.
DESCRIÇÃO DA ATIVIDADE:
Inicialmente, o professor deverá perguntar aos alunos se eles já ouviram falar em solubilidade e se conhecem a definição e a distinção entre soluto e solvente, buscando, assim, identificar o que os alunos já conhecem a respeito do assunto que será abordado nesta aula. Após ouvir as respostas dos alunos, o docente deverá orientar os alunos a lerem a seguinte reportagem: Modificação dos Efeitos Medicamentosos no Organismo disponível em http://www.infoescola.com/farmacologia/modificacao-dos-efeitos-medicamentosos-no-organismo/. O texto explica os principais fatores responsáveis por alterar a absorção de medicamentos, entre eles a solubilidade. Depois da leitura do texto, o professor deverá perguntar aos alunos: “Qual a relação entre a solubilidade e os remédios?” ou “O que irá determinar a solubilidade dos remédios?”.
Finalizados os comentários dos alunos, o professor deverá aprofundar o assunto apresentando o vídeo Aí tem química! Solubilidade I e discutir com os alunos sobre as aplicações deste assunto no cotidiano.
O professor poderá relacionar a reportagem do início da aula com o vídeo, comentando a importância dos solutos e solventes na produção dos remédios e estabelecendo uma relação com a solubilidade dos fármacos na água.
O professor deverá registrar na lousa, junto com os alunos, os conceitos e tipos de soluções e, posteriormente, mostrar o segundo vídeo, Aí tem química! Solubilidade II.
Após a exibição do segundo vídeo, o professor organizará a turma em grupos e solicitará a elaboração de textos sobre a solubilidade e as soluções. Cada equipe deverá escolher dois exemplos de soluções que não foram citados nos vídeos e criar um texto (com no mínimo 10 linhas) descrevendo-os. Nos textos, as soluções deverão ser classificadas como diluídas, concentradas, saturadas ou supersaturadas, e também deverá ser apresentada uma justificativa para a classificação proposta. Deverá ser comentado o tipo de solução quanto ao estado do soluto e solvente. Por exemplo, solução do tipo líquido-líquido, líquido-sólido ou gás-gás, etc.
Sugestão: Os textos deverão ser postados no grupo do Facebook, que será criado na Atividade 2. Ressaltando ainda que os alunos deverão ser estimulados a curtir ou comentar os textos de outras equipes.
MOMENTO DO ALUNO:
Neste momento, os alunos desenvolverão a atividade proposta.
DISCUSSÃO:
Os grupos deverão apresentar os textos elaborados (e, posteriormente, publicá-los no Facebook). Após as apresentações, o professor deverá propor uma discussão entre os discentes sobre a definição da palavra solubilidade: “capacidade que uma substância tem de se dissolver em outra”. O objetivo é chamar a atenção dos alunos para o fato de que o solvente não é apenas a água, sugere-se estimulá-los a listarem exemplos de outros solventes além dos apresentados nos vídeos.
SISTEMATIZAÇÃO:
Após a discussão com os alunos, o professor deverá propor a realização do “Jogo da Sorte” para formalizar o conteúdo abordado. O docente deverá escrever em pequenos papéis frases incompletas sobre tipos de soluções e solubilidade. Os papéis devem ser dobrados e colocados em uma caixa de papelão. O professor deverá fechar a caixa e passar entre os alunos (sugestão: organizar a turma em um círculo). A caixa deverá circular entre os alunos e o professor (de costa para a turma) deverá mencionar, quando quiser, as direções do jogo, seguem as instruções necessárias:
Direções do “Jogo da Sorte”
- PARE: a pessoa que está com a caixa deverá pegar um papel e completar a frase;
- VOLTA: a pessoa que está com a caixa deverá passá-la para o colega que estava antes com ela e este preencher a frase sorteada;
- PASSA: a pessoa que está com a caixa deverá passá-la para o colega que estiver do lado (o próximo) e este completar a frase;
- PARE, MAS ESCOLHA UM: a pessoa que estiver com a caixa deverá escolher um colega para completar a frase a ser sorteada.
À medida que as frases forem sendo completadas, o docente revisará com os alunos o conteúdo estudado. Seguem abaixo algumas sugestões:
- As misturas homogêneas são denominadas ______________.
- Uma solução é formada por um ____________ e por um ______________.
- _____________ é um exemplo de solução formada por gás – líquido.
- As soluções podem ser diluídas quando apresentam _______________.
- Quando as soluções têm mais solutos são _____________ .
- Soluções saturadas são __________________.
- A solubilidade de alguns solutos pode diminuir com o ________________.
- Ar, o latão e água do mar são exemplos de _________________.
- Soluções que contém a máxima quantidade de soluto numa dada quantidade de solvente, a uma determinada temperatura são soluções ______________.
- Os tipos de solução são _______________, _________________, ___________________, ____________ e _______________.
- As ligas metálicas são um exemplo de solução _________________.
- A solubilidade é importante para a produção de remédios porque ______________.
ATIVIDADE 2 – EXPLORANDO A SOLUBILIDADE
2.1 INSTRUÇÕES INICIAIS
Esta atividade será desenvolvida no LIE, na sala de aula e em espaços extrassala. Serão utilizados computadores com acesso à internet, projetor data-show, câmera digital ou celular, caderno para anotações e caneta ou lápis.
2.2 INTRODUÇÃO
Inicialmente, com o intuito de realizar a introdução à atividade, o professor deverá apresentar a imagem abaixo (figura 3), perguntar aos discentes se eles já ouviram falar em “crescimento de cristais” e propor outros questionamentos sobre o assunto: “Como podemos fazer cristais em casa?” e “Qual a relação entre a formação de cristais e a solubilidade?”.
Figura 3: Cristal

Fonte: http://www.pontociencia.org.br/experimentos-interna.php?experimento=257&CRESCENDO+CRISTAIS#top
Após essa conversa inicial, o professor deverá propor aos alunos a elaboração de um “Seminário sobre Soluções”, qual a turma será dividida em cinco grupos. Os alunos apresentarão o seminário na sala de aula, e o professor deverá filmar as apresentações com o uso de uma câmera digital ou celular, pois este material será postado no facebook.
2.3 MOMENTO DA PESQUISA
Este momento deverá ser acompanhado pelo professor para que o mesmo tenha possibilidade de orientar a exploração e o desenvolvimento dos assuntos para a apresentação do seminário. Seguem os temas que serão apresentados por cada equipe com a sua respectiva orientação e sugestões de sites para consulta:
Grupo 1: Solubilidade e a dissociação iônica
Orientação: o grupo deverá abordar o processo de dissolução e a dissociação iônica, mostrando, assim, uma visão microscópica deste processo.
- Dissolução de um soluto em um solvente
- Tópico: Uma visão mais detalhada sobre do processo de dissolução
http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_solubilidade.pdf
Grupo 2: Coeficiente de solubilidade e curva de solubilidade
Orientação: o grupo deverá abordar o coeficiente de solubilidade dos materiais e a construção e significado da curva de solubilidade, destacando a necessidade de atenção adequada à unidade de medida padrão (g de soluto/100 g do solvente).
- Coeficiente de Solubilidade
http://www.infoescola.com/fisico-quimica/coeficiente-de-solubilidade/
- Curva de Solubilidade
http://www.vestibulandoweb.com.br/quimica/teoria/curva-de-solubilidade.asp
- Curvas de Solubilidade?
http://www.agracadaquimica.com.br/index.php?&ds=1&acao=quimica/ms2&i=22&id=605
Grupo 3: Experimento - Crescimento de cristal
Orientação: o grupo deverá realizar o experimento extrassala com o auxílio do professor. Todas as etapas do experimento devem ser fotografadas ou filmadas, e as imagens ou filmagens devem ser apresentadas no seminário. A equipe deverá apresentar e explicar os resultados obtidos com o experimento, assim como ressaltar as dificuldades encontradas.
- Crescendo cristais: parte 1: experimento prático http://portaldoprofessor.mec.gov.br/fichaTecnica.html?id=29146
- Física do estado sólido – Crescimento de Cristais http://fisica.uc.pt/data/20032004/apontamentos/apnt_039_8.pdf
- Soluções saturadas e solubilidade
http://www.proenc.iq.unesp.br/index.php/quimica/200-solucoes-supersat
Grupo 4: Lei de Henry e a influência da pressão e temperatura
Orientação: o grupo deverá abordar os fundamentos da Lei de Henry e a influência da pressão e da temperatura na solubilidade dos solutos nos solventes.
- Solução
http://www.brasilescola.com/quimica/solucao.htm
- Soluções
http://www.mundoeducacao.com.br/quimica/solucoes.htm
- Solubilidade dos gases em líquidos - A Lei de Henry
http://educacao.uol.com.br/quimica/solubilidade-dos-gases-em-liquidos-a-lei-de-henry.jhtm
Grupo 5: Relacionando o cotidiano com a solubilidade
Orientação: o grupo deverá trazer exemplos dos fatores que influenciam a solubilidade (temperatura e pressão), assim como apresentar curiosidades da aplicação do conhecimento de solubilidade na tecnologia dos fluidos e das soluções. Entre estas, é importante comentar sobre o desenvolvimento da respiração de fluidos. Sugere-se que, se possível, a equipe traga experiências para sala de aula.
- Por que o refrigerante espuma quando está quente?
- As bolhas fatais do mergulho
- Experimento da solubilidade de gás em líquido
http://diariodeumquimicodigital.com/experimento-da-solubilidade-de-gas-em-liquido
- Respirando fluido
http://lealchemyst.blogspot.com.br/2009/07/respirando-fluido.html
- Além das bolhas...
http://alemdasbolhas.blogspot.com.br/2011/01/respirar-liquido-uma-possibilidade-no.html
- Humanos podem respirar um líquido ao invés de ar?
http://hypescience.com/humanos-podem-respirar-um-liquido-ao-inves-de-ar/
- INTRIGANTE - Existe o líquido respirável?
http://alquimistaspontocom.blogspot.com.br/2010/01/intrigante-existe-o-liquido-respiravel.html
- Medicina – A respiração artificial
http://pt.shvoong.com/medicine-and-health/1804070-medicina-respira%C3%A7%C3%A3o-artificial/
- Oxigênio na veia permite que você viva mesmo sem respirar
http://hypescience.com/oxigenio-na-veia-permite-que-voce-viva-mesmo-sem-respirar/
*Todos os sites tiveram acesso em 01/outubro/2012.
2.4 INSTRUÇÕES ACERCA DO SEMINÁRIO
- Deverá ser marcado um dia para a culminância dos trabalhos realizados até então. O vídeo da apresentação deverá ter no máximo 20 minutos, ou seja, o tempo a ser destinado para as apresentações dos grupos;
- Cada seminário deve conter introdução ao tema, desenvolvimento e conclusão;
- Os alunos deverão contextualizar o tema de acordo com a orientação dada ao grupo;
- Nos seminários, a exposição temática será através de slides com o uso do projetor data-show;
- Após cada apresentação, deverá ser disponibilizado um tempo para perguntas da plateia e do professor.
Ao final dos seminários, os grupos devem fornecer a bibliografia utilizada, e o professor deverá propor uma problemática a ser analisada e discutida entre os alunos na rede social a partir da seguinte pergunta: “Qual a relação da solubilidade com a alta mortandade de peixes em rios e lagos poluídos? Como é possível modificar essa situação? Expliquem”. Essa pergunta deverá relacionar o grau de poluição no ambiente com a quantidade de oxigênio dissolvido. A mortandade dos peixes estará diretamente ligada com a diminuição do oxigênio dissolvido. Caso os alunos tenham dificuldade de responder sobre como mudar a situação dos rios e lagos poluídos, o professor deverá comentar sobre a importância de manter esses ambientes sob intensa agitação (método da aeração), com a agitação haverá maior contato da água com o ar, e, consequentemente, uma maior oxigenação da água.
Obs.: Essa pergunta será postada no grupo do Facebook, e todas as equipes deverão respondê-la na rede social com um prazo de três dias (discussão baseada no livro Química Física Química 2 - João Usberco e a Edgard Salvador. Editora Saraiva. 2006).
2.4 CRIANDO UM GRUPO NO FACEBOOK
-Após as apresentações, o professor deverá orientar os alunos a criarem uma conta no Facebook, através do site: http://www.facebook.com/ (deverá ser utilizada uma conta na rede social para cada equipe). Em seguida, professor e alunos deverão criar um grupo fechado para a turma. Mais dicas de como criar um grupo na rede social podem ser encontradas no seguinte endereço eletrônico: http://www.dicastutorial.com/2012/02/como-criar-um-grupo-no-facebook.html.
2.5 COMPARTILHANDO NO FACEBOOK:
Convém ressaltar que o professor deve acompanhar as postagens dos alunos para conhecer e orientar suas intervenções, além de estimular a participação da turma através da rede social, pois o facebook nesta aula se apresenta como ferramenta pedagógica. As filmagens gravadas dos seminários devem ser postadas posteriormente no grupo da rede social, Facebook. Lembrando que as equipes devem comentar ou curtir as postagens das apresentações dos outros grupos.
Tabela 1 - Cronograma da atividade 2
| - Atividade 2 - |
|||
| Etapas |
Desafios Propostos |
Duração |
Local |
| 1°Etapa |
Pesquisa nos sites |
2 hora/aula |
LIE |
| 2° Etapa |
Elaboração dos seminários |
7 dias |
Extrassala |
| 3° Etapa |
Apresentação dos seminários |
3 horas/aula |
Sala de aula |
| 4°Etapa |
Criação do grupo no Facebook |
2 horas/aula |
Extrassala |
| 5°Etapa |
Postagem das filmagens das apresentações no Facebook |
1 dia |
Extrassala |
| 6°Etapa |
Comentário dos alunos e professor sobre as apresentações – Facebook |
2 dias |
Extrassala |
| 7° Etapa |
Comentário dos alunos sobre a problemática levantada pelo professor – Facebook |
3 dias |
Extrassala |
Fonte: Criação do autor
ATIVIDADE 3 - SEJA UM CIENTISTA FORENSE! PARTICIPE DO CSI DA SUA TURMA E VERIFIQUE UMA APLICAÇÃO DA CIÊNCIA PARA O BEM DA SOCIEDADE.
INSTRUÇÕES INICIAIS
Esta atividade será desenvolvida no laboratório de ciências da escola. Será necessário o uso de caderno, caneta ou lápis. Cada grupo terá o material já disponível na sua bancada. O docente acordará com os alunos as regras abaixo:
- Participação na atividade;
- Atenção ao momento em que o professor realizar o experimento;
- Organização da turma em círculo.
- Materiais necessários para o experimento:
- 46 g de NaNO3 (nitrato de sódio - material para capacitação);
- 144 g de KNO3(nitrato de potássio - evidência 1);
- 348 g de C12H22O11 (açúcar de confeiteiro – evidência 2);
- 4 termômetros científicos (que possam medir de 10° a 80° C);
- 100 ml de água destilada;
- 4 varetas para agitação;
- Béqueres e tubos de ensaio grandes (20x200 mm);
- Aparelho para aquecer (bico de bunsen ou fogareiro);
- Cubos de gelo (para realizar as medidas abaixo da temperatura ambiente ou esfriar as soluções mais rapidamente);
- Balança (para pesar entre 2 e 30 g);
- Materiais de segurança como óculos e luvas para a pessoa que irá manusear a solução devido ao perigo de projeção de reagentes químicos (os alunos devem alternar esta posição para que todos participem).
OBS: É de extrema importância que os alunos NÃO saibam a identidade do material até o momento oportuno! Deve-se, pois, chamar os materiais pelos termos em negrito.
3.1 CONVIDANDO OS ALUNOS A SE ENVOLVEREM NA NUMA INVESTIGAÇÃO
Inicialmente, o professor deverá propor o seguinte questionamento: “Qual a importância de se conhecer a solubilidade nos dias de hoje?”. Os alunos deverão relembrar o que foi estudado e citar situações diferentes das apresentadas nas atividades anteriores. Para estimular a participação e o envolvimento dos alunos na atividade em desenvolvimento, o docente deverá perguntar: “Vocês já pensaram em desvendar um crime a partir do conhecimento sobre solubilidade?”, e, em seguida, explicar que eles participarão de uma “Investigação CSI”, baseando-se no conhecimento adquirido nas atividades e pesquisas anteriores.
3.2 APRESENTANDO O OBJETO DE INVESTIGAÇÃO
O professor deverá apresentar a situação a ser investigada da seguinte forma:
Será realizada uma “Investigação CSI” para desvendar o autor de um assalto a uma residência durante a viagem dos proprietários. Os peritos encontraram algumas evidências na cena do crime:
Evidência 1: Pó de material não identificado nas pegadas dentro da casa ao lado da janela arrombada.

Fonte: http://www.elo7.com.br/pegadas-papai-noel/dp/E519E
Evidência 2: As impressões digitais estavam borradas, sem possibilidade de identificação. Entretanto, foram deixados vestígios de um material não identificado nos locais onde o invasor tocou.

Fonte: http://www.passeiweb.com/saiba_mais/voce_sabia/impressao_digital
As evidências 1 e 2 devem ser processadas e identificadas pela perícia forense (os alunos). Para que o caso seja resolvido o quanto antes, quatro equipes da perícia foram acionadas, ficando cada grupo responsável em identificar uma amostra via curva de solubilidade. Como são duas evidências, ficarão dois grupos com a mesma amostra e, ao final, farão uma média dos valores encontrados, obtendo, assim, maior confiabilidade no resultado obtido.
Para realizar a tarefa, os novos peritos passarão por uma capacitação, que nada mais é do que seguir o professor na construção da curva de solubilidade de um sal inorgânico no laboratório (NaNO3), procedimento este que será utilizado pelos grupos em seguida para solucionar o caso.
3.3 PROCEDIMENTO EXPERIMENTAL PARA CAPACITAÇÃO E INVESTIGAÇÃO CSI
A construção da curva de solubilidade dos materiais propostos será realizada determinando as temperaturas de sete ou oito soluções de composições conhecidas quando estas se tornam saturadas (fato observável pelo início da cristalização). Uma sugestão do aparato experimental é apresentada na figura 4, onde o professor pode adaptá-la de acordo com a realidade da escola.
Figura 4: Arranjo experimental
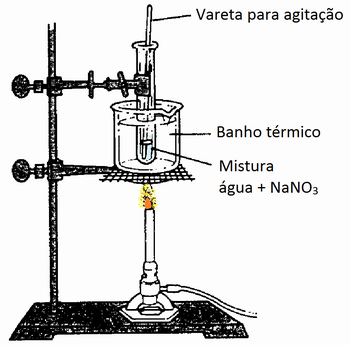
Fonte: Investigating the Solubility Of a Salt and the Effects Temperature has on it, http://www.cpet.ufl.edu/bestpractices/Changes%20in%20Matter.html(modificada pelo autor).
Deve-se pesar previamente as seguintes massas dos materiais:
| *Material para capacitação (g) – (Professor) |
**Evidência 1 (g) (Equipe 1 e 2) |
**Evidência 2 (g) (Equipe 3 e 4) |
| 9 |
2 |
20 |
| 10 |
4 |
21 |
| 12 |
6 |
22 |
| 15 |
8 |
24 |
| - |
10 |
26 |
| - |
12 |
29 |
| - |
14 |
32 |
| - |
16 |
- |
* Serão encontradas apenas quatro temperaturas na capacitação. O professor deverá desenhar o gráfico da curva de solubilidade, no quadro, utilizando uma escala que permita inserir no mesmo gráfico os pontos das evidências que as equipes encontrarão posteriormente. Não identificar o sal neste momento da aula.
** Realizar a pesagem para as duas equipes e disponibilizar os dados nas respectivas bancadas.
3.4 PROCEDIMENTO LABORATORIAL CSI PARA CADA VALOR DE MASSA PESADA
Os grupos deverão seguir as instruções abaixo:
1. Transferir com cuidado a massa para o tubo de ensaio grande;
2. Adicionar 10 ml de água destilada e agitar lentamente;
3. Colocar a mistura no banho térmico controlando a temperatura para evitar a fervura da solução;
4. Quando o material se dissolver completamente, retirar o tubo de ensaio do banho térmico, colocar um termômetro na solução e deixar esfriar. A partir deste momento, deve-se sempre agitar cuidadosamente o tubo de ensaio;
5. Anotar a temperatura na qual o sal começa a cristalizar (se necessário, utilize água gelada para resfriar a solução);
6. Repetir a determinação da temperatura de saturação reaquecendo a solução até que os pequenos cristais se dissolvam e faça à média. Caso os valores não sejam compatíveis, repetir o procedimento experimental.
Finalizadas as medições, as equipes que receberam a mesma evidência farão a média dos seus resultados e, junto com o professor, desenharão as curvas de solubilidade no gráfico que já se encontra no quadro.
Neste momento o docente deverá:
- Reforçar a atenção dos discentes aos procedimentos de segurança no laboratório;
- Visitar os grupos para acompanhar os dados obtidos e solicitar que repitam a medida caso necessário;
- Fotografar os gráficos no quadro ao final do experimento para garantir um registro dos dados.
*OBS: Experimento baseado no Experimento 1 – Construção da curva de solubilidade do KNO3.
Universidade Federal do Paraná – Departamento de Química – CQ-029
Química Inorgânica e Experimental.
3.5 A IDENTIFICAÇÃO DAS EVIDÊNCIAS
Com as equipes em posse dos resultados laboratoriais, o professor, chefe da equipe CSI, entregará para cada equipe uma cópia impressa do gráfico abaixo:
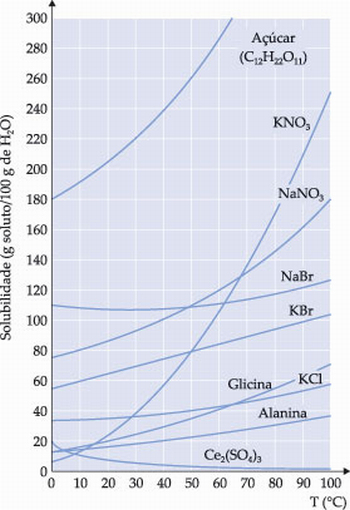
Fonte: http://www.vestibulandoweb.com.br/quimica/teoria/curva-de-solubilidade.asp
Observando e comparando o gráfico experimental com o gráfico impresso, os alunos deverão identificar suas substâncias, inclusive a amostra tratada pelo professor na capacitação dos peritos. São estas:
- Material da capacitação: NaNO3 (nitrato de sódio)
- Evidência 1: KNO3 (nitrato de potássio)
- Evidência 2: C12H22O11(açúcar)
3.6 APRESENTANDO E DISCUTINDO A SOLUÇÃO DO CASO NA REDE SOCIAL
O restante da investigação será através da rede social. Serão repassadas as hipóteses que a equipe de policiais criou baseada nos testemunhos coletados no local do assalto. A equipe de investigação chegou a três possíveis suspeitos:
- O encanador que foi recentemente a casa realizar serviço no banheiro;
- O novo jardineiro, que também trabalha na cozinha de uma confeitaria à noite;
- O entregador de garrafão de água, que trabalha numa fábrica de fogos de artifício à noite.
Cada equipe forense terá dois dias para publicar na rede social o autor do crime de acordo com a ligação que fizeram entre as evidências identificadas e a vida cotidiana do suspeito, expondo as suas respectivas justificativas. Para isto, as equipes deverão realizar uma pesquisa sobre os materiais identificados buscando saber onde eles podem ser encontrados. Em seguida, os alunos terão um dia para comentar e discutir a solução do caso pela outra equipe, justificando a concordância ou discordância para a solução do crime.
3.7 A IDENTIFICAÇÃO DO AUTOR DO CRIME
Após as equipes postarem seu principal suspeito, o chefe da equipe CSI publicará a identidade do autor do crime apresentando a ligação das evidências:
Evidência 1: No solado do sapato do invasor existia nitrato de potássio, KNO3, material muito utilizado na fabricação de fogos de artifício e em fertilizantes.
Evidência 2: Foi encontrado vestígio de açúcar de confeiteiro nas impressões digitais deixadas pelo invasor.
Junto com o resultado, o professor deverá postar uma foto da curva de solubilidade produzida pelas equipes forense.
Em seguida, o professor deverá apresentar a conclusão do caso: o autor do crime é o novo jardineiro! Não podendo contra-argumentar em razão das evidências, o jardineiro acabou confessando ser culpado.
3.8 FINALIZAÇÃO
O docente solicitará aos alunos que, no Facebook, comentem sobre a experiência vivida durante o processo de investigação “CSI” proposto na atividade, como também sobre a aplicação da ciência para o bem da sociedade.
O professor deverá chamar a atenção dos alunos para o fato de que eles utilizaram grande quantidade dos materiais na atividade. Entretanto, os peritos forenses profissionais trabalham com técnicas que necessitam de uma quantidade muito pequena de amostra. E, para concluir, o professor poderá perguntar aos alunos: “Vocês acreditam que esta técnica seja realmente conveniente na investigação criminal? Por quê?” .
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Aí tem química! - Solubilidade I | Vídeo |
| Aí tem química! - Solubilidade II | Vídeo |
Recursos Complementares
Sugestões de links para alunos
Como criar páginas no Facebook
http://www.osabetudo.com/tutorial-como-criar-paginas-no-facebook/
Vídeo – Como fazer cristais
http://www.youtube.com/watch?v=rzt68-dwSdQ
Sugestões de links para professores
Outros experimentos – Crescimento de cristais
http://www.seara.ufc.br/sugestoes/fisica/espec1.htm
Facebook para Educadores
http://educotraducoes.wordpress.com/2012/05/06/facebook-para-educadores/
Links do Portal que podem ser consultados pelo professor no planejamento de sua aula
Como usar as redes sociais a favor da aprendizagem
http://portaldoprofessor.mec.gov.br/linksCursosMateriais.html?categoria=84
Entenda como funciona o Facebook
http://portaldoprofessor.mec.gov.br/buscarMateriais.html?busca=facebook&categoria=&x=7&y=13
Avaliação
Na atividade 1, o professor deverá verificar se os alunos compreenderam os conceitos fundamentais de solubilidade, soluto, solvente e solução, a partir da relevância dos textos produzidos. Na atividade 2, o professor poderá averiguar se houve entendimento dos alunos em relação à curva de solubilidade, aos fatores que influenciam a solubilidade, as soluções concentradas, saturadas e supersaturadas, como também aplicações desse conteúdo curricular em situações cotidianas por meio do desempenho das equipes nos seminários e os comentários dos discentes na rede social. Na atividade 3, recomenda-se avaliar se os discentes compreenderam as etapas de produção da curva de solubilidade, assim como a aplicação da ciência em uma investigação criminal, a partir dos argumentos construídos ao longo do processo investigativo.
Cinco estrelas 1 classificações
- Cinco estrelas 1/1 - 100%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Eliane, Colegio Militar de jequié , Bahia - disse:
eliane_quimica@yahoo.com.br19/02/2014
Cinco estrelasExcetente material
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus

