04/11/2008
Wildson Luiz Pereira dos Santos
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Propriedades das substâncias e dos materiais |
O que o aluno poderá aprender com esta aula
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Estratégias e recursos da aula
Conteúdo Específico
• Composição quantitativa de uma solução.
Recurso Educacional Digital
 Simulador - soluções- com atividades para simular o preparo de soluções e o cálculo das concentrações dessas.
Simulador - soluções- com atividades para simular o preparo de soluções e o cálculo das concentrações dessas.
Sugestão de Aula
Preparando a aula
Na aula anterior a esta, solicite aos alunos que tragam de casa recortes da frente da caixa de algum medicamento que eles tenham em casa e que tragam se possível a bula. Peça que o aluno traga, também, um rótulo de uma garrafa de água sanitária.
Ou leve duas garrafas contendo café, em uma delas com café “forte” e outra com café “fraco”, e dois copos transparentes.
Introduzindo a aula (5 a 10 min.)
Inicialmente leve os alunos para o laboratório de informática, oriente-lhes para que se agrupem em duplas, cada dupla utilizará um computador. Informe aos alunos qual programa eles utilizarão nessa aula: Browser para navegação na internet e calculadora.
Explique aos estudantes que eles irão aprender a preparar soluções por meio de um simulador de laboratório localizado na web, bem como determinar as concentrações das soluções por eles preparadas e de algumas outras que o professor indicará durante a aula.
Oriente os alunos a prestarem muita atenção às orientações e dicas que aparecem ao longo da simulação para que tenham o máximo de êxito e possa operar o simulador da melhor maneira possível.
Para introduzir a aula, peça aos alunos que leiam as descrições contidas na frente da caixa do medicamento que eles levaram. Pergunte a eles o que eles acreditam significar a quantidade informada na caixa e por que todos os medicamentos têm indicação de quantidade das substâncias que os compõem (o valor que é descrito na caixa do medicamento é referente à quantidade da substância que é o princípio ativo do medicamento). Explique aos alunos que os medicamentos na sua maioria s ão misturas (soluções sólidas), e que o princípio ativo é encontrado em quantidades pequenas e são estas quantidades que estão denominadas junto ao nome da substância ativa, e são os químicos que determinam precisamente, por meio de testes as quantidades das substâncias existentes em quaisquer materiais.
Simule a seguinte situação com os alunos:
Se ao tomar uma xícara de café uma pessoa derramasse um pouco na roupa, seria fácil retirar a mancha deixada pelo café? Quais atitudes a pessoa poderia tomar para tirar a mancha da roupa?
Ouça as sugestões dos alunos, assim poderá ser observado se eles conhecem o uso de substâncias químicas para retiradas de manchas em tecidos.
Explique aos alunos que este tipo de representação da concentração é designado concentração em massa (Cm/V). É a maneira usual de representar a concentração de soluções. É a expressão da quantidade do soluto (massa - m1, em gramas) por unidade de volume da solução (V, em litros). Podemos utilizar uma forma mais compacta de expressar Cm/V:
A concentração das soluções obtidas também pode ser expressa a partir da quantidade de matéria contida no frasco, essa concentração é denominada concentração em quantidade de matéria (Cn/V). Essa forma de representar a concentração é muito utilizada pelos químicos, sendo preferida no dia a dia em laboratório por conter as relações estequiométricas e representar melhor as quantidades contidas numa determinada solução. Cn/V é expressa em mol por litro (mol/L) e podemos representá-la pela fórmula:
onde n é a razão entre a massa do soluto (em gramas) e a massa molecular do mesmo em gramas por mol (g/mol).
Sugestões de alternativas para a introdução da aula
Caso ten ha levado as garrafas contendo café, diga aos alunos que você preparou dois cafés. Coloque o caf&e acute; forte em um copo e o café fraco em outro. Peça aos estudantes que descrevam as diferenças que eles observam entre os líquidos contidos nos copos. Palavras como cor forte e fraca (intensidade), diluição, concentração, solução e mistura poderão aparecer durante a descrição dos alunos. Explique o significado dessas palavras e faça relações entre estas palavras e o conteúdo que os estudantes irão aprender na aula, ou seja, calcular a quantidade de uma determinada substância (soluto) que encontra-se diluída (dissolvida, ionizada) numa determinada quantidade de outra substância (solvente). Reforce com os alunos que o solvente que estaremos utilizando durante a simulação é a água, uma substância com caráter polar que é capaz de solubilizar, principalmente, outras substâncias polares.
Simule a seguinte situação com os alunos:
Se ao tomar uma xícara de café, uma pessoa derramasse um pouco na roupa, seria fácil retirar a mancha deixada pelo café? Quais atitudes a pessoa poderia tomar para tirar a mancha da roupa?
Ouça as sugestões dos alunos, assim poderá ser observado se eles conhecem o uso de substâncias químicas para retiradas de manchas em tecidos.
Desenvolvendo a aula (20 a 25 min.)
Peça aos estudantes que acessem o site do simulador e comecem a simulação seguindo os passos descritos a seguir.
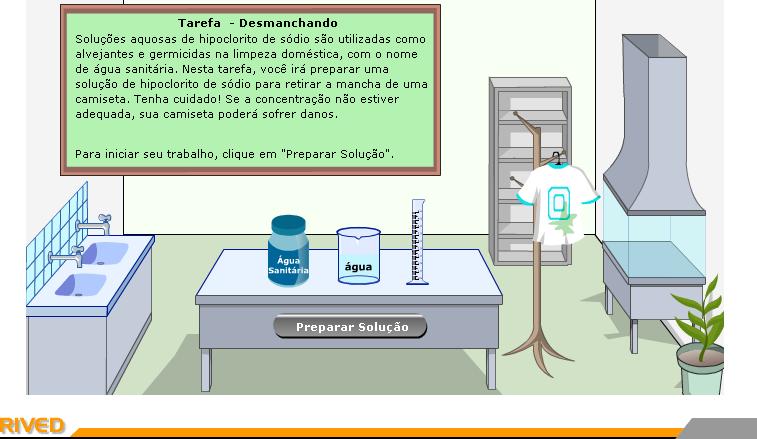
i) Ler a descrição da tarefa contida no quadro verde, localizado na abertura do simulador;
ii) Clicar no botão “Preparar Solução”;
iii) Responder à pergunta: “você já utilizou água sanitária? Para quê?
Ouça os alunos e em seguida pergunte para a turma por que algumas marcas de água sanitária não são tão eficientes quanto outras?
Após ouvir as respostas, explique que a quantidade de hipoclorito de sódio presente nas marcas com melhor desempenho na limpeza é maior do que a das marc as com desempenho
abaixo do esperado, ou seja, a concentração da primeira solução é maio r do que a da segunda.
Antes de iniciar a simulação informe aos alunos que o procedimento correto para preparar soluções é adicionar primeiro o solvente e depois o soluto. Neste simulador essa seqüência
está invertida.
iv) Após os alunos lerem as instruções contidas no quadro de cor rosa no simulador, pergunte se eles sabem a quantidade, em ml, da solução de NaOCl que deverá ser utilizada para o
preparo de 1 litro de solução a fim de obterem no final, uma solução com concentração suficiente para retirada da mancha da roupa.
Caso os alunos tenham dificuldade na obtenção da quantidade. Explique que ela poderá ser encontrada a partir da regra de três abaixo:
200 ml de NaOCl ____ 20 L de água
V ml de NaOCl _____ 1 L de água
Peça para os alunos repetirem os mesmos passos para o preparo de 500 ml de solução de NaOCl com a mesma concentração.
Oriente os alunos que anotem o valor da concentração das duas soluções (esses valores são mostrados quando o botão “Testar” é selecionado).
Sistematizando a aula (20 min.)
Peça aos alunos que respondam às questões sugeridas abaixo para que eles possam exercitar e solucionar questões referentes ao conteúdo aprendido durante a simulação. O professor
deverá circular na sala verificando se as duplas estão compreendendo as questões solicitadas. Ao final da aula, os alunos deverão ser capazes de responder às questões propostas.
Questões sugeridas
i) Quais as concentraç ões das soluções de NaOCl preparadas na simulação? Dê sua resposta para Cm/V e Cn/V.
ii) Quais as massas de NaOCl contidas nas soluções da pergunta i) ? Utilize a tabela periódica para calcular a massa molar desta substância.
iii) Determine a massa, em gramas, de NaOCl necessária para preparar uma solução de concentração 1,5 mol/L.
iv) Calcule a quantidade matéria (mol) necessária para preparar uma solução de NaOCl de concentração 1,5 g/L.
v) Verifique no rótulo que você trouxe qual a quantidade de NaOCl está contida no frasco. Como esta quantidade está representada? Calcule Cm/V e Cn/V.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Soluções | Animação/simulação |
Recursos Complementares
Site com definições e exemplos sobre misturas. Acesse o site no endereço eletrônico http://nautilus.fis.uc.pt/mocho/local/local/unfinished/nini1/2/3.html.
Site com definições e exercícios sobre as Grandezas de medidas fundamentais. Acesse o site no endereço eletrônico http://educar.sc.usp.br/ciencias/fisica/mf5.htm.
Avaliação
Sem estrelas 0 classificações
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncie opiniões ou materiais indevidos!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


 Soluções
Soluções