24/11/2013
Alfredo Luis Martins Lameirão Mateus
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
O que o aluno poderá aprender com esta aula
· Compreender o aspecto dinâmico do equilíbrio químico.
· Sistematizar o fenômeno por meio de relações matemáticas.
· Diferenciar concentrações constantes de concentrações iguais.
· Compreender o significado da constante de equilíbrio.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
· Reversibilidade de reações químicas.
· Coexistência de espécies em equilíbrio químico.
· Concentração de soluções.
· Cinética química (pode ser retrabalhado na atividade)
Estratégias e recursos da aula
Esta aula é baseada na Monografia intitulada “DESENVOLVIMENTO DE SEQUÊNCIAS DIDÁTICAS PARA O ENSINO DE EQUILÍBRIO QUÍMICO” desenvolvida por Gabriel Matos Vieira, sob orientação do Prof. Alfredo Luis Martins Lameirão Mateus, apresentada ao Curso de Química do Departamento de Química da Universidade Federal de Minas Gerais, como requisito parcial para obtenção do título de Licenciado em Química.
Orientações Iniciais ao Professor
Esta aula faz parte de uma sequência de três aulas sobre o tema Equilíbrio Químico. A aula anterior se chama “Introdução ao Equilíbrio Químico: reversibilidade de reações e coexistência de espécies” e a aula seguinte se chama “Fatores que afetam o Equilíbrio Químico” e as duas estão disponíveis no Portal do Professor.
Nesta aula propomos um aprofundamento no estudo do estado de equilíbrio químico considerando a dinâmica do equilíbrio químico. Consideraremos, também, os aspectos matemáticos que surgem a partir de relações estabelecidas entre as concentrações das espécies presentes e as velocidades das reações direta e inversa.
Para o desenvolvimento dessas atividades, sugerimos a utilização de recursos computacionais disponíveis na internet. Se for possível, sugerimos que o professor leve seus alunos a uma sala de informática para que eles possam manusear estes recursos. Caso não seja possível, pode-se utilizar apenas um computador e um projetor para mostrar aos alunos o recurso enquanto o professor mesmo o manuseia. Sugerimos que ao longo das atividades o professor proponha questões a seus alunos e que finalize entregando a eles um texto de síntese dos aspectos abordados.
A dinâmica do equilíbrio químico é um dos aspectos mais importantes a serem trabalhados para ampliar a compreensão deste conceito e também um dos mais difíceis de ser ensinado e aprendido. Este aspecto diz respeito à continuidade das reações direta e inversa mesmo depois de estabelecido o equilíbrio químico. Para abordar a ideia de continuidade de forma experimental seria preciso utilizar técnicas espectroscópicas avançadas. Acreditamos que uma boa alternativa é utilizar uma simulação de computador que representa o fenômeno no nível molecular. Nesta aula, sugerimos uma simulação do portal PhET chamada Sais e Solubilidade.
Os aspectos matemáticos do equilíbrio químico também são importantes para que os alunos aprendam a organizar de forma sistemática informações relacionadas ao estado de equilíbrio químico. As relações entre as concentrações das espécies presentes no sistema e as velocidades das reações direta e inversa estabelecem valores constantes que podem trazer importantes informações sobre o estado em que se encontra o sistema e sobre os tipos de reações que estão ocorrendo. Acreditamos que uma forma interessante de trabalhar esses aspectos é a utilização de planilhas eletrônicas que apresentem os valores das concentrações das espécies presentes, que podem ser manipulados de forma a se obter novas relações entre esses valores e diferentes constantes de equilíbrio. Para abordar os aspectos matemáticos sugerimos uma atividade chamada Cinetiqueitor/Equilibreitor do portal pontociência.
Sobre a simulação Sais e Solubilidade
A simulação sais e solubilidade está disponível no Banco Internacional de Objetos Educacionais (BIOE), no endereço a seguir.
http://objetoseducacionais2.mec.gov.br/handle/mec/22240
Antes de iniciar a atividade, sugerimos que o professor explore a simulação para saber quais são os seus recursos e como utilizá-los. Para auxiliar nesta tarefa, iremos fazer uma breve explicação sobre o seu funcionamento.
Ao acessar o endereço da simulação, é possível baixá-la ao clicar em Copiar. É necessário que o computador esteja com uma versão atualizada do JavaTM. Verifique isso ao tentar abrir uma simulação. Caso ela não abra, deve-se acessar o endereço <http://www.java.com/pt_BR/> e clicar em Download Gratuito do Java e, em seguida, em Concordar e Inicializar o Download Gratuito. O arquivo de instalação do JavaTM deve ser salvo no computador e, então, instalado.
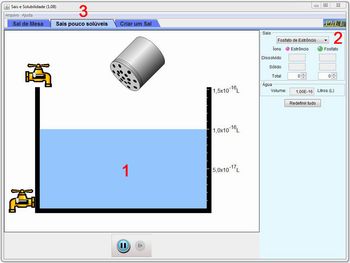
Na simulação está representado um recipiente com água (1) em que podem ser adicionados sais com diferentes solubilidades. Ela apresenta, também, um painel (2) que contabiliza o número de partículas dissolvidas e não dissolvidas. Para determinar qual sal será adicionado, é possível escolher entre sal de cozinha, sais pouco solúveis ou um sal criado pelo próprio usuário (3). Vale destacar que as representações não estão em escala. Por exemplo, o saleiro é bem maior que as torneiras.
Na atividade proposta, serão utilizados apenas os sais pouco solúveis. A quantidade de água da solução também pode ser alterada, mas este recurso não será utilizado na atividade proposta.
Para trabalhar com sais pouco solúveis, deve-se clicar na aba com este nome na parte superior da tela.

O sal a ser adicionado pode ser escolhido no painel à direita.
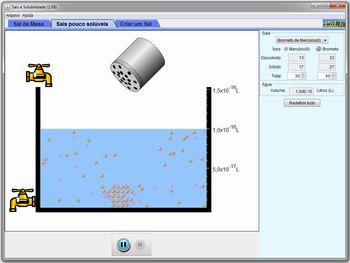
Depois de selecionar o sal, pode-se adicioná-lo clicando-se no saleiro que aparece acima do recipiente e agitando-o. Quando o sal for adicionado, ele irá dissociar-se na solução e os íons irão adquirir mobilidade. Se a quantidade de sal adicionado for suficiente para saturar a solução, parte dele irá permanecer na forma de sólido, ao fundo do recipiente, mas a parte dissolvida irá continuar se movendo. As partículas dissolvidas e o sólido mantêm um equilíbrio, pois ao mesmo tempo em que partículas do sólido se desprendem e vão para a solução, partículas da solução são agregadas ao sólido. A variação média no número de partículas dissolvidas ou no sólido é nula.
Outro recurso importante que a simulação apresenta é a forma de exibição, que pode ser contínua ou passo a passo. Os botões a seguir controlam esta opção.

Ao iniciar a simulação, a forma de exibição selecionada é a contínua. Para mudar de forma, deve-se clicar no botão de pausa (1), que está na parte inferior da simulação, e, então, deve-se clicar repetidas vezes no botão de passo a passo (2) localizado ao lado do botão de pausa. Para retornar à exibição contínua, deve-se clicar no botão iniciar (3), que substitui o botão de pausa no momento em que ele é acionado.
Por se tratar de uma representação de um fenômeno, a simulação apresenta limitações. Acreditamos que seja muito importante que o professor chame à atenção dos alunos essas limitações para evitar que elas comprometam a compreensão de alguma forma. No caso da simulação Sais e Solubilidade, algumas das limitações são:
· A simulação não representa uma reação, e sim uma dissolução. Apesar disso, a dinâmica das partículas representada pode ajudar na compreensão dos dois fenômenos. É importante, porém, que o professor discuta as diferenças entre eles.
· A água é representada de forma contínua, e não como um corpo composto de moléculas.
· O equilíbrio é atingido apenas quando ocorre a saturação do sistema. No caso de reações em equilíbrio químico, o estabelecimento do equilíbrio não depende das quantidades envolvidas.
Sobre o Cinetiqueitor/Equilibreitor
A atividade Cinetiqueitor/Equilibreitor está disponível no portal pontociência e pode ser acessada no endereço a seguir.
http://pontociencia.org.br/experimentos-interna.php?experimento=995
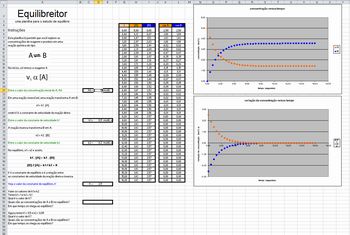
O Cinetiqueitor/Equilibreitor é uma atividade desenvolvida para um estudo mais amplo a respeito das relações matemáticas que se estabelecem em um sistema em equilíbrio químico. O usuário pode explorá-lo considerando a velocidade das reações direta e inversa para determinar a constante de equilíbrio. Porém, esta abordagem requer a compreensão de aspectos relacionados à cinética da reação. Portanto, é importante que Cinética Química já tenha sido discutida previamente com os alunos.
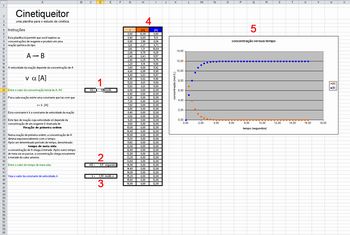
Para auxiliar os alunos a relembrarem os aspectos cinéticos, a aba Cinetiqueitor permite que se faça uma manipulação de valores em uma reação do tipo A → B. Nessa aba, é possível variar a concentração inicial de A (1) e o tempo de meia-vida (2) da reação, ou seja, o tempo necessário para que a concentração de A se reduza à metade. Essas manipulações resultam em um valor de constante de velocidade (3), importante para a determinação da constante de equilíbrio do sistema A B, que é representado na aba Equilibreitor. Para manipular esses valores, basta que o usuário insira os valores desejados de [A]0 e t½. Ao fazer isso, os valores de concentração de A e B (4) são atualizados no quadro presente na planilha e é construído um gráfico (5) que representa a variação das concentrações dessas espécies.
B, que é representado na aba Equilibreitor. Para manipular esses valores, basta que o usuário insira os valores desejados de [A]0 e t½. Ao fazer isso, os valores de concentração de A e B (4) são atualizados no quadro presente na planilha e é construído um gráfico (5) que representa a variação das concentrações dessas espécies.
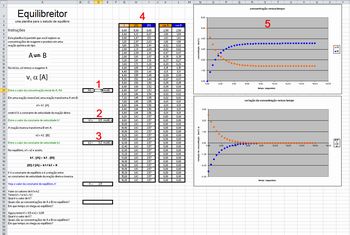
Na aba Equilibreitor, o usuário pode manipular valores relativos a um sistema do tipo A B. Nessa aba, o usuário pode alterar os valores de [A]0 (1) e os valores das constantes de velocidade das reações direta (2) e inversa (3). Ao fazer isso, os valores de concentração de A e B e da taxa de variação de suas concentrações (4) são atualizados e gráficos que representam esses valores (5) são construídos.
B. Nessa aba, o usuário pode alterar os valores de [A]0 (1) e os valores das constantes de velocidade das reações direta (2) e inversa (3). Ao fazer isso, os valores de concentração de A e B e da taxa de variação de suas concentrações (4) são atualizados e gráficos que representam esses valores (5) são construídos.
Atividade 1 – Dinâmica do Equilíbrio Químico
Para abordar a dinâmica do equilíbrio químico, sugerimos que o professor explore com seus alunos a simulação Sais e Solubilidade e faça uma discussão sobre o sistema representado por ela. Sugerimos que leve seus alunos a uma sala de informática e permita que, divididos em pequenos grupos (dois ou três por grupo), possam manusear a simulação. Caso não seja possível leva-los a uma sala de informática, sugerimos que o professor utilize um computador e um projetor para exibir a simulação a seus alunos enquanto ele a manuseia.
Sugerimos que o professor proponha um roteiro de exploração da atividade acompanhado por questões de discussão a serem respondidas ao longo da aula. Abaixo, disponibilizamos um roteiro que pode ser entregue aos alunos.
http://pontociencia.org.br/aulas/equilibrio/Atividade_2-1_Roteiro.docx
Após a discussão das questões propostas, sugerimos que o professor entregue a seus alunos um texto que sintetiza os aspectos abordados na atividade. A seguir, disponibilizamos uma sugestão para esse texto.
http://pontociencia.org.br/aulas/equilibrio/Atividade_2-1_Texto_final.docx
Atividade 2 – Aspectos Matemáticos do Equilíbrio Químico
Este aspecto pode ser abordado por meio da atividade Cinetiqueitor/Equilibreitor. Sugerimos que a atividade seja realizada na sala de informática, se possível, ou com um computador conectado a um projetor para exibir a atividade enquanto ele a manuseia.
Para explorar a atividade, sugerimos novamente que o professor entregue a seus alunos um roteiro de atividade acompanhado por questões de discussão. Esse roteiro pode ser acessado no endereço a seguir.
http://pontociencia.org.br/aulas/equilibrio/Atividade_2-2_Roteiro.docx
Para finalizar a atividade, após a discussão das questões propostas, o professor pode entregar novamente um texto que sintetiza os aspectos abordados na aula. Abaixo, disponibilizamos uma sugestão para esses texto.
http://pontociencia.org.br/aulas/equilibrio/Atividade_2-2_Texto_final.docx
Referência
VIEIRA, G.M. Desenvolvimento de sequências didáticas para o ensino de equilíbrio químico. 2012. 56 f. Monografia (Licenciatura em Química) – Instituto de Ciências Exatas, Universidade Federal de Minas Gerais, Belo Horizonte, 2012.
Recursos Complementares
Sugerimos que o professor leia o artigo "Como os estudantes concebem o estado de equilíbrio químico", publicado na revista Química Nova na Escola. Nesse artigo, as autoras fazem uma discussão aprofundada a respeito das dificuldades que os estudantes apresentam para compreender os aspectos relacionados ao equilíbrio químico e sugerem caminhos para que essas dificuldades sejam superadas. O artigo pode ser acessado no endereço a seguir.
Como os estudantes concebem o estado de equilíbrio químico
A seguir, indicamos um trabalho apresentado no XV Encontro Nacional do Ensino de Química intitulado "Simulando o Equilíbrio Químico: Uma Ferramenta para uso dos Professores no Ensino Médio". Esse trabalho apresenta uma alternativa de atividade com planilhas eletrônicas para o estudo de Equilíbrio Químico.
Avaliação
Sugerimos que o professor avalie por meio do desempenho dos alunos e das respostas dadas por eles às questões propostas na atividade.
Sem estrelas 0 classificações
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncie opiniões ou materiais indevidos!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


