08/12/2013
Andréa Horta Machado
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
O que o aluno poderá aprender com esta aula
- Compreender o que são modelos teóricos;
- Compreender o desenvolvimento histórico envolvido na construção dos modelos atômicos de Rutherford e Bohr;
- Compreender os resultados do experimento de Rutherford;
- Analisar e sistematizar as características do modelo de Rutherford;
- Analisar e compreender como ocorrem as transições eletrônicas;
- Analisar e compreender as características do modelo de Bohr;
- Sistematizar as características do modelo de Bohr;
- Entender as limitações apresentadas pelos modelos.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
É necessário que os alunos já tenham estudado os modelos atômicos de Dalton e Thomson.
Estratégias e recursos da aula
Esta aula é baseada na monografia intitulada “MODELOS PARA O ÁTOMO: ATIVIDADES COM A UTILIZAÇÃO DE RECURSOS MULTIMÍDIA” desenvolvida por Glenda Rodrigues da Silva, sob a orientação de Andréa Horta Machado, apresentada ao curso de Química do Departamento de Química da Universidade Federal de Minas Gerais, como requisito parcial para obtenção de título de licenciado em Química.
Estrutura da aula
Observação: esta aula faz parte de uma sequência de três aulas sobre o tema Modelos para o átomo. As aulas anteriores se chamam "Do modelo de Dalton ao modelo de Thomson: a consolidação do átomo" e “Para se chegar ao modelo de Rutherford: a história da radioatividade” e também estão disponíveis no Portal do Professor.
Para este tema não há muitos experimentos que podem ser desenvolvidos, então utilizaremos simulações e vídeos para que os alunos façam atividades que permitirão, com o auxílio do professor, que os modelos atômicos de Rutherford e Bohr sejam abordados, assim como o momento histórico em que foram desenvolvidos. Professor, você encontrará a seguir orientações dirigidas a você com sugestões de como os recursos listados podem ser utilizados e em seguida algumas atividades para serem realizadas com os alunos, se desejar entregue-as a seus alunos.
Para trabalhar com essas atividades você precisará de um computador e um projetor multimídia ou uma sala de informática. Para essas atividades os alunos podem ser divididos em grupos de 05 a 06 alunos.
Para todas as atividades são indicados links em que os materiais podem ser encontrados em formato pdf. Os pdfs contém links que direcionam para o site Youtube. Entretanto, ao longo da aula disponibilizamos links que direcionam para o portal BIOE em que os mesmos recursos podem ser encontrados. Professor, você poderá escolher qual link utilizar para acessar o recurso sugerido
ATIVIDADE 1: Modelo de Rutherford
1.1- Orientações ao professor
A introdução ao modelo de Rutherford pode ser feita a partir dos fatos históricos que o antecederam. Rutherford foi um importante físico e químico e estava interessado pelos fenômenos radioativos até então observados. Ele estudou inúmeros destes fenômenos e recebeu um Nobel em 1908 por suas pesquisas nesta área. Quando estava pesquisando como era a interação da radiação com os materiais acabou se deparando com um fenômeno que o modelo de Thomson não era capaz de explicar, uma limitação do modelo. O experimento que propusera - o estudo da interação entre a radiação alfa e os materiais - ficou conhecido como Espalhamento de Rutherford e foi realizado por Geiger e Marsden, dois alunos de Rutherford. A interpretação dos resultados deste experimento levou à elaboração de um novo modelo para o átomo.
Para analisar o experimento realizado por pela equipe de Rutherford sugerimos o uso da simulação “Espalhamento de Rutherford” disponível no Portal PhET.
A simulação pode ser acessada no link a seguir:
http://objetoseducacionais2.mec.gov.br/handle/mec/3080
Nesta simulação é possível se fazer uma análise a nível atômico dos resultados obtidos com o experimento. A simulação trata de um átomo de ouro sendo incidido por partículas alfa.
1.2- Utilizando a simulação
Na parte superior da simulação há a aba Átomo de Rutherford e Átomo Pudim de Passas. Clicando na opção Átomo de Rutherford temos ao centro da tela um núcleo atômico com prótons e nêutrons. Por padrão a simulação ilustra o átomo de ouro. Nos cantos do quadrado que contornam esse núcleo temos uma trajetória circular tracejada representando a eletrosfera e uma bolinha azul representando um elétron. Ao lado esquerdo temos uma Pistola de partículas alfa que pode ser ativada com um clique e libera as partículas alfa que incidiram no átomo. A frente da pistola há um retângulo amarelo representando uma lâmina de ouro. Note que nessa lâmina há um pequeno quadrado e que o quadrado localizado ao centro da tela corresponde aquele pequeno quadrado após uma grande ampliação.
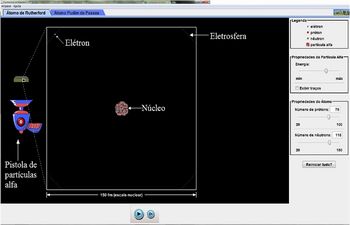
Figura 1 - Simulação Espalhamento de Rutherford. Em destaque o núcleo, a eletrosfera e o elétron. Fonte: Portal PhET
Ao lado direito temos o comando Propriedades da partícula alfa e o controle deslizante Energia que nos permite variar a energia das partículas alfa incidentes. Há também o comando Exibir traços que quando ativado mostra a trajetória das partículas alfa. Em Propriedades do Átomo temos os controles deslizantes Número de prótons e Número de nêutrons que permitem variar o átomo analisado, basta mover o cursor alterando os valores ou digitá-los nos campos correspondentes. O comandoReiniciar tudo? desfaz todas as alterações retornando a simulação à configuração padrão.
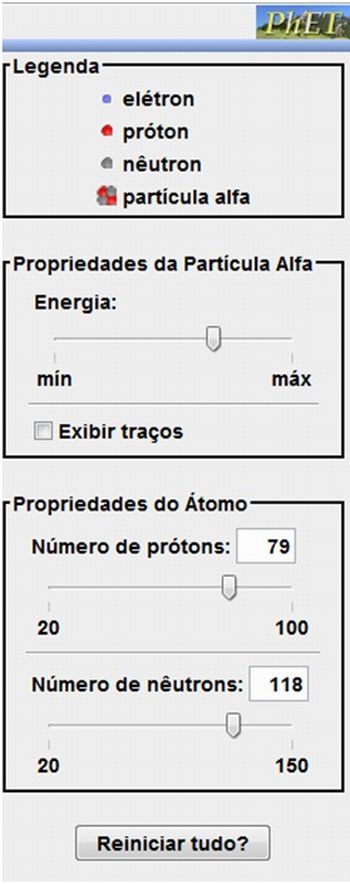
Figura 2 - Simulação Espalhamento de Rutherford. Em destaque o menu lateral direito. Fonte: Portal PhET
Na parte inferior da simulação há os comandos de Pause representado por dois traços verticais que param a simulação permitindo uma análise mais detalhada do que está ocorrendo. Este comando se converte ao comando Play representado por um triângulo quando o comando Pause é acionado e neste momento também é ativado o comando Step representado por um traço vertical e um triângulo que permitem a evolução mais lenta da simulação.
A simulação reproduz o experimento, mas deve-se ficar atento a alguns pontos importantes. A simulação traz o núcleo do átomo contendo prótons e nêutrons. Como sabemos até aquele momento os nêutrons não eram conhecidos e Rutherford se referia ao núcleo apenas como uma região de carga positiva. Rutherford supunha a existência dos nêutrons, mas essas partículas foram identificadas apenas na década de 1930, cerca de 20 anos depois da realização deste experimento.
A proporção entre o tamanho do núcleo e a distância núcleo-eletrosfera também pode ser trabalhada nesta simulação, visto que nos cantos do quadrado que limita o átomo apresentado há uma linha tracejada por onde circula um elétron. É importante salientar para os alunos que esta simulação não está em escala e esta distância é apenas simbólica como forma de representar a grande diferença desta proporção.
A simulação permite ainda que se varie o átomo testado, então é possível investigar e discutir como a variação do tamanho do núcleo atômico interfere nos desvios das partículas alfa, lembrando que a alteração do número de nêutrons não afeta a trajetória das partículas. Outro aspecto muito interessante desta simulação é o de permitir a comparação entre os modelos de Thomson e Rutherford, pois com ela pode-se demonstrar que não há grandes desvios quando o experimento é feito com o modelo de Thomson. Dessa forma explica-se porque este modelo foi substituído pelo de Rutherford.
1.3- Atividades para o aluno
A seguir trazemos um roteiro para auxiliar na utilização desta simulação. O roteiro encontra-se neste link http://pontociencia.org.br/aulas/modelo_atomico/Roteiro_aluno_aula_3_1.docx
ATIVIDADE 2: Teste de chama e Espectro eletromagnético
O modelo de Bohr pode ser introduzido com a realização do teste de chama. Caso a escola não possua condições de realizá-lo sugerimos que seja utilizado o vídeo “Teste atômico” de autoria do Portal pontociência.

Figura 3 – Cena do vídeo Teste Atômico. Fonte: Portal pontociência.
Neste vídeo é realizado o teste de chama para algumas substâncias contendo elementos metálicos na composição e percebemos a cor da chama característica destes. Pode-se perguntar aos alunos se eles são capazes de explicar o observado utilizando os modelos atômicos já estudados.
Os links do vídeo estão a seguir:
http://objetoseducacionais2.mec.gov.br/handle/mec/21706- parte 1
http://objetoseducacionais2.mec.gov.br/handle/mec/21707- parte 2
Neste momento os alunos ficam curiosos sobre as diferenças de cores observadas nos testes. Para ajudar nessa explicação sugerimos que o professor trabalhe o espectro eletromagnético da luz mostrando aos alunos a relação entre a energia da onda eletromagnética e seu comprimento de onda com a cor por nós observada. Para isso pode-se utilizar a animação “Espectro Eletromagnético”que traz as características das diversas radiações, além dos cuidados que devemos ter ao nos expormos a elas.
A animação pode ser encontrada no link a seguir:
http://objetoseducacionais2.mec.gov.br/handle/mec/17484
ATIVIDADE 3: Modelo atômico de Bohr
3.1- Orientações ao professor
Para a representação do modelo de Bohr pode-se utilizar a simulação “The Bohr model”, Figura 4.
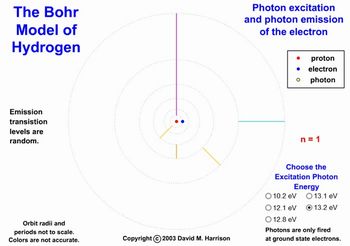
Figura 4 - Simulação The Bohr Model em execução. Fonte: David M. Harrison
A simulação pode ser encontrada aqui:
http://objetoseducacionais2.mec.gov.br/handle/mec/17906
Esta simulação exibe o átomo de hidrogênio com o núcleo formado por uma pequena esfera vermelha que corresponde ao próton e as órbitas estacionárias propostas por Bohr são círculos pontilhados em torno do núcleo. Nestas órbitas um elétron (esfera pequena azul) está girando e pode mover-se entre elas exemplificando as transições eletrônicas. Para isto um fóton (pequena esfera amarela) vai de encontro ao elétron. A energia do fóton que irá excitar o elétron pode ser alterada no comando Choose the Excitation Photon Energy no canto direito inferior e os valores de energia são dados em eV (elétron-volt) – 1,602.10-19 J.
As transições eletrônicas são representadas por traços coloridos que abrangem os níveis ocupados pelo elétron quando excitado e após emitir fótons. Os traços entre os níveis apresentam cores aleatórias, não indicando, portanto, a cor real observada no espectro de emissão do átomo de hidrogênio. Para se acompanhar entre quais níveis estão ocorrendo as transições ao lado direito da tela há uma letra n que apresenta valores variando de 1 a 6 que são os níveis energéticos exibidos nesta simulação.
3.2- O átomo de Bohr – orientações aos alunos
A seguir trazemos um roteiro para auxiliar na utilização desta simulação. O roteiro encontra-se neste link http://pontociencia.org.br/aulas/modelo_atomico/Roteiro_aluno_aula_3_2.docx
Referências
SILVA, G.R.Modelos para o átomo: atividades com a utilização de recursos multimídia. 2012. 35 f. Monografia (conclusão de curso) - Universidade Federal de Minas Gerais, Instituto de Ciências Exatas, Departamento de Química, Belo Horizonte.
Recursos Complementares
Uma análise crítica das analogias “bola de bilhar”, “pudim de passas” e “sistema solar” utilizadas para o ensino de química em modelos atômicos.
Disponível em: http://www.quimica.ufpr.br/eduquim/eneq2008/resumos/R0588-1.pdf. Acesso em: 19 de novembro de 2013.
Avaliação
Para avaliar a turma sugerimos que seja utilizada a simulação “Modelos do átomo de hidrogênio” do Portal PhET disponível em http://objetoseducacionais2.mec.gov.br/handle/mec/3236
Esta é uma simulação mais complexa e traz todos os modelos citados além do modelo atual denominado na simulação modelo de Schroëdinger e de de Broglie. Ela nos dá a opção de se utilizar o modo experimental e o modo de predição dos modelos. Isso permite fazer a comparação do comportamento entre o que é possível predizer para todos osmodelos quando submetidos a um feixe de luz monocromático ou um feixe de luz branca e o comportamento real de um átomo submetido às mesmas condições. O modelo para esse átomo não é mostrado tendo sido substituído por uma interrogação. Dessa forma o aluno pode ser instigado a descobrir qual dos modelos apresentados é compatível ao observado experimentalmente.
Além disso, pode-se pedir aos alunos que discutam os resultados observados para os átomos representados quando são incididos com a luz monocromática ou um feixe de luz branca. As explicações devem se apoiar nas características já estudadas para cada modelo.
Cinco estrelas 1 classificações
- Cinco estrelas 1/1 - 100%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Elder Luis, Grupo CEV , Piauí - disse:
elderluis2014@hotmail.com18/08/2015
Cinco estrelasGostei
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


