08/12/2013
Daniela da Silveira Leite, Lilian Borges Brasileiro
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
O que o aluno poderá aprender com esta aula
· Compreender a lei de conservação das massas
· Compreender a lei das proporções definidas
· Compreender o balanceamento de equações químicas
· Compreender o conceito de mol
· Calcular a massa molar de uma substância
· Reconhecer a existência de reagentes em excesso
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Reconhecimento de reações químicas
Estratégias e recursos da aula
Esta aula é baseada na Monografia intitulada “SEQUÊNCIA DIDÁTICA PARA O ENSINO DE ESTEQUIOMETRIA” desenvolvida por Daniela da Silveira Leite, sob orientação da Profª. Lilian Borges Brasileiro, apresentada ao Curso de Química do Departamento de Química da Universidade Federal de Minas Gerais, como requisito parcial para obtenção do título de Licenciado em Química.
Orientações iniciais ao professor
Esta aula aborda, em uma sequência de quatro atividades, algunsaspectos essenciais para a compreensão das ideias de mol e estequiometria. São propostas atividades nas quais os alunos devem observar fenômenos e, em seguida, responder a algumas questões. Uma das atividades propõe a exploração de uma simulação para computador. Os experimentos propostos são do Portal pontociência e estão disponíveis no Banco Internacional de Objetos Educacionais (BIOE). A simulação é do portal PhET (InteractiveSimulations – Universityof Colorado) e também está disponível no BIOE.
Para iniciar a sequência, foi proposta uma discussão a respeito da Lei de Lavoisier, ou Lei de Conservação das Massas. Essa lei considera que, quando ocorre uma reação química, a massa total dos materiais envolvidos se conserva, ou seja, a massa total dos reagentes é igual à massa total dos produtos. Essa compreensão é essencial para o entendimento das relações entre as quantidades envolvidas nas reações químicas. Para abordar esse assunto, foi proposta uma discussão a partir do experimento “Química: uma ciência conservadora?”.
Uma forma muito importante de se representar uma reação química é por meio das equações químicas. Uma conclusão que podemos tirar da Lei de Conservação das Massas é que os átomos que estavam presentes nos reagentes devem estar presentes, também, nos produtos. Para que uma equação química represente corretamente uma transformação química, ela deve estar balanceada. Para abordar isso, foi proposta uma discussão a partir do experimento “A massa se conserva”.
Duas ferramentas muito importantes para os químicos são as ideias de mol e massa molar. Elas são essenciais para uma boa compreensão das quantidades envolvidas nas transformações químicas. Por outro lado, a compreensão dessas ideias não é simples. É comum que os estudantes entendam o mol apenas como um número, sem nenhum tipo de significado real. Para auxiliá-los nessa compreensão, foi proposta uma discussão a partir do experimento “Quanto vale um mol?”.
As ideias discutidas nas atividades mencionadas são muito importantes para o entendimento dos cálculos estequiométricos, ou seja, a determinação das quantidades envolvidas nas transformações químicas. Para abordar isso, foi proposta uma discussão a partir da exploração da simulação “Reagentes, Produtos e excesso”.
Atividade 1 – Química: uma ciência conservadora?
Disponibilizamos, a seguir, um link para o material que pode ser impresso e distribuído aos alunos. Esse material apresenta o roteiro do experimento com algumas questões para discussão.
http://pontociencia.org.br/aulas/estequiometria/Atividade_1_Roteiro.docx
Se não for possível executar o experimento em sala de aula, sugerimos que o professor exiba o vídeo do experimento filmado, fazendo pausas se considerar adequado e retornando sempre que for necessário. O vídeo pode ser acessado no link a seguir.
http://objetoseducacionais2.mec.gov.br/handle/mec/24300
Sugerimos que o professor solicite a seus alunos para que respondam as questões propostas no roteiro. Essas questões podem ser respondidas durante a execução do experimento ou após. Para finalizar a aula, sugerimos que seja discutido o texto disponível no link a seguir, que sistematiza os aspectos trabalhados nessa atividade.
http://pontociencia.org.br/aulas/estequiometria/Atividade_1_Texto_final.docx
Atividade 2 – A massa se conserva
Sugerimos que o professor inicie a atividade com algumas questões que retomam as ideias da aula anterior, aplicadas a uma situação problema. No link a seguir, o professor pode acessar o roteiro do experimento, que pode ser impresso e distribuído aos alunos.
http://pontociencia.org.br/aulas/estequiometria/Atividade_2_Roteiro.docx
Após a discussão das questões iniciais, realiza-se o experimento. Se não for possível executá-lo em sala de aula, sugerimos que o professor exiba o vídeo do experimento filmado, fazendo pausas nos momentos em que considerar adequado e retornando sempre que for necessário. O vídeo pode ser acessado no link a seguir.
http://objetoseducacionais2.mec.gov.br/handle/mec/24457
Sugerimos que os alunos respondam a algumas questões de discussão, durante a execução do experimento ou após. Para auxiliar a discussão final da aula, sugerimos que seja lido o texto, disponível no link a seguir,que sistematiza os aspectos trabalhados. Nesse texto, são discutidos os resultados dos experimentos e alguns aspectos das equações químicas. É importante notar que, os coeficientes estequiométricos são tratados, num primeiro momento, como números de átomos, uma vez que o conceito de quantidade de matéria (mol) ainda não foi introduzido.
http://pontociencia.org.br/aulas/estequiometria/Atividade_2_Texto_final.docx
Atividade 3 – Quanto vale um mol?
Sugerimos que o professor comece a atividade com a discussão proposta pelas questões iniciais, disponíveis no material para o aluno que pode ser impresso a partir do link a seguir. Em seguida, sugere-se realizar o experimento.
http://pontociencia.org.br/aulas/estequiometria/Atividade_3_Roteiro.docx
Se não for possível executar o procedimento em sala de aula, sugerimos que o professor exiba o vídeo do experimento filmado, fazendo pausas nos momentos em que achar conveniente e retornando sempre que for necessário. O vídeo pode ser acessado no link a seguir.
http://objetoseducacionais2.mec.gov.br/handle/mec/24263
Sugerimos que os alunos respondam a algumas questões de discussão. Essas questões podem ser respondidas durante ou após a execução do experimento. Para finalizar a aula, sugerimos que seja realizada a leitura comentada do texto que sistematiza os aspectos trabalhados, disponível no link a seguir.
http://pontociencia.org.br/aulas/estequiometria/Atividade_3_Texto_final.docx
Atividade 4 – Reagentes, produtos e excesso
Nesta atividade propõe-se o uso de uma simulação disponível no Portal PHET e no BIOE. Você pode acessar a simulação em um dos endereços:
http://objetoseducacionais2.mec.gov.br/handle/mec/24421
http://phet.colorado.edu/pt_BR/simulation/reactants-products-and-leftovers
OBSERVAÇÃO: A simulação requer uma versão atualizada do JavaTM. O professor pode verificar isso ao tentar abrir uma simulação. Caso ela não abra, deve-se acessar o endereço <http://www.java.com/pt_BR/> e clicar em Download Gratuito do Java e, em seguida, em Concordar e Inicializar o Download Gratuito. Salvar o arquivo de instalação do JavaTM no computador e, então, instalá-lo.
A partir do preparo de sanduíches, a simulação faz uma analogia com uma reação química real, que permite discutir os conceitos de reagente em excesso e reagente limitante.
A simulação é dividida em três abas: “Loja de Sanduíches”, “Reações Reais” e “Jogar!”. A “Loja de Sanduíches” tem a finalidade de ilustrar para o estudante as proporções existentes nas reações químicas por meio de uma analogia com a proporção existente em uma receita de sanduíche. A simulação permite ao usuário criar uma receita para o sanduíche. Permite ainda que sejam selecionadas as quantidades disponíveis de cada ingrediente.
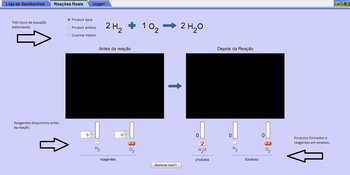
As “Reações Reais”, na segunda aba, irão ilustrar para o estudante as proporções de cada reagente de uma reação química. As moléculas são representadas utilizando-se o modelo de Dalton. A simulação permite que o usuário selecione a quantidade de cada reagente antes da reação e, então, exibe o produto formado e os excessos, após a reação.
A aba “Jogar!” oferece um desafio para que os estudantes balanceiem várias equações químicas em um tempo determinado. As atividades propostas nessa aba podem ser utilizadas como avaliação.
Conhecendo a simulação
Algumas informações sobre o uso da simulação são comentadas a seguir.
Parte 1: Loja de sanduíches
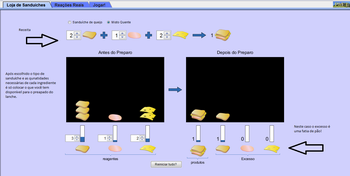
Nesta aba você pode montar dois tipos de sanduíches: de queijo e misto quente.
· Selecione o tipo de sanduíche.
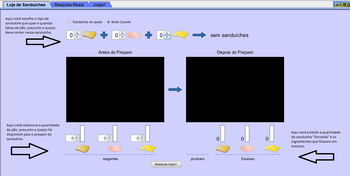
· Crie a “receita”, selecionando as quantidades de cada ingrediente. Um sanduíche só é formado se for selecionado um mínimo de dois pães.
· Em “Antes do Preparo”, selecione as quantidades de ingredientes disponíveis. À medida que as quantidades forem determinadas, o painel “Depois do Preparo” irá mostrar quais ingredientes estão em excesso e quantos sanduíches foram preparados.
Parte 2: Reações Reais
· Na segunda aba, selecione uma das três reações disponíveis.
· Em “Antes da reação”, selecione as quantidades de reagentes disponíveis. Assim como na aba anterior, o painel “Depois da Reação” irá mostrar os produtos formados e os reagentes em excesso.
Trabalhando com a simulação
Para o desenvolvimento dessa atividade, sugerimos, se possível, que o professor leve seus alunos a uma sala de informática para que eles possam manusear a simulação, individualmente ou em pequenos grupos. Caso não seja possível, o professor pode utilizar apenas um computador e um projetor para mostrar a seus alunos o recurso enquanto ele mesmo o manuseia.
A seguir, disponibilizamos um link com uma sugestão de roteiro que pode ser entregue aos alunos.
http://pontociencia.org.br/aulas/estequiometria/Atividade_4_Roteiro.docx
Após a discussão das questões propostas no roteiro do aluno, sugerimos que o professor leia com os alunos um texto que sintetiza os aspectos abordados na atividade. Abaixo, disponibilizamos um link com uma sugestão para esse texto.
http://pontociencia.org.br/aulas/estequiometria/Atividade_4_Texto_final.docx
Bibliografia
LEITE, D.S. Sequência Didática Para o Ensino de Estequiometria. 2013. 37f. Monografia (Licenciatura em Química) - Instituto de Ciências Exatas, Universidade Federal de Minas Gerais, Belo Horizonte, 2013.
Recursos Complementares
Sugerimos que o professor utilize a simulação "Balanceamento de Equações" do portal PhET para aprofundar a ideia de balanceamento de equações. A seguir, disponibilizamos o link que dá acesso à simulação e um tutorial de utilização para ela.
Simulação - http://objetoseducacionais2.mec.gov.br/handle/mec/24253
Tutorial - http://pontociencia.org.br/aulas/estequiometria/Balanceamento_de_Equacoes.pdf
A seguir, disponibilizamos o link de um experimento do Portal pontociência chamado "Visualizando o volume molar". Com ele, é possível criar um modelo que representa o volume ocupado por um mol de um gás perfeito nas condições normais de temperatura e pressão (25 ºC, 1 atm). O professor pode utilizar esse modelo para aprofundar a ideia de mol e relacioná-la a outros contextos para além do balanceamento de equações químicas ou do cálculo de massas molares.
Avaliação
Sugerimos que o professor avalie por meio do desempenho dos alunos e das respostas dadas por eles às questões propostas na atividade. O jogo proposto na 3ª aba da simulação é uma ferramenta interessante e pode ser usado como avaliação.
Cinco estrelas 1 classificações
- Cinco estrelas 1/1 - 100%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Isabela , Estudante do ISE-UNIFEB Matemática , São Paulo - disse:
isafnds92@gmail.com17/06/2015
Cinco estrelasÓtima a aula, adorei o conteúdo e principalmente o simulador dos sanduíches!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


