17/12/2013
Alberto Valadares Neto, Ulisses de Farias, Andréa Horta Machado, Katia Pedroso Silveira
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Modelos de constituição: substâncias, transformações químicas |
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
O que o aluno poderá aprender com esta aula
· Compreender como a concentração de reagentes, superfície de contato e temperatura podem interferir na velocidade de uma reação química.
· Compreender a teoria das colisões e utilizá-la para explicar como ocorre uma reação química.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
· Evidências de reações químicas
· Modelo cinético-molecular
Estratégias e recursos da aula
Esta aula é baseada na Monografia intitulada “CINÉTICA DAS REAÇÕES QUÍMICAS: ELABORAÇÃO DE ROTEIROS DE AULAS TEÓRICO-EXPERIMENTAIS COM ENFOQUE INVESTIGATIVO” desenvolvida por Alberto Valadares Neto, sob orientação da Profª. Andréa Horta Machado, apresentada ao Curso de Química do Departamento de Química da Universidade Federal de Minas Gerais, como requisito parcial para obtenção do título de Licenciado em Química.
Esta aula é baseada na Monografia intitulada “UMA PROPOSTA INVESTIGATIVA PARA O ESTUDO DA CINÉTICA DAS REAÇÕES QUÍMICA” desenvolvida por Ulisses de Farias, sob orientação da Profª. Katia Pedroso Silveira, apresentada ao Curso de Química do Departamento de Química da Universidade Federal de Minas Gerais, como requisito parcial para obtenção do título de Licenciado em Química.
Orientações Iniciais ao Professor
Esta aula aborda os principais fatores que interferem na velocidade das reações químicas. Sugerimos a realização de atividades que envolvam discussões a partir de experimentos nos quais esses fatores são considerados. Abordamos o efeito da temperatura, da superfície de contato entre as espécies reagentes e da concentração. Além disso, propomos uma discussão a respeito das colisões efetivas e sua relação com a velocidade das reações químicas. Para esta aula, sugerimos atividades que envolvem experimentos disponíveis no portal pontociência (http://pontociencia.org.br) e uma simulação do portal PhET (http://phet.colorado.edu/pt_BR/).
O aumento da temperatura faz com que as partículas dos reagentes adquiram mais energia. Isso aumenta a probabilidade de essas partículas se encontrarem para que ocorra a reação química e o resultado global disso é o aumento da velocidade da reação química. Por outro lado, quando os reagentes possuem maior superfície de contato, há, também, maior probabilidade de eles se encontrarem, o que também aumenta a velocidade da reação química. Para abordar esses dois fatores, sugerimos uma discussão a respeito do experimento “Velocidade de reação com comprimidos efervescentes”.
Outro fator muito importante que interfere na velocidade de uma reação química é a concentração dos reagentes, quando estes se encontram em solução. Novamente, quanto maior a concentração, maior será a probabilidade de os reagentes se encontrarem, o que acarreta em um aumento global da velocidade da reação. Para abordar isso, sugerimos uma discussão a respeito do experimento “Relógio de iodo”.
A teoria das colisões é uma forma de se explicar, sob uma perspectiva submicroscópica, as reações químicas. Ela afirma que, para que ocorra uma reação química, as partículas que constituem os reagentes devem colidir. Portanto, ela confirma a ideia de que, para ocorrer uma reação química, é preciso que os reagentes estejam em contato. Para abordar isso, sugerimos uma discussão a respeito do experimento “Cinética dos gases”.
Mas não basta que os reagentes colidam para que a reação ocorra. Essas colisões devem ocorrer com energia e orientação adequadas. Este é um aspecto difícil de ser visualizado por meio de experimentos. Portanto, sugerimos uma exploração da simulação “Reações e taxas” para abordar o assunto.
Atividade 1 - Velocidade de reação com comprimidos efervescentes
A seguir, disponibilizamos um link com o roteiro do experimento “Velocidade de reação com comprimidos efervescentes” e algumas sugestões de exploração do experimento.
http://pontociencia.org.br/aulas/Cinetica/Atividade_1-1_Roteiro.docx
Sugerimos que o professor entregue o roteiro da atividade a seus alunos para que eles realizem o experimento e respondam às questões propostas. Se não for possível realizar o experimento, sugerimos que o professor exiba um vídeo do experimento com um projetor, fazendo pausas nos momentos adequados e repetindo-o sempre que necessário. A seguir, disponibilizamos o link do roteiro experimental no portal pontociência que contém um vídeo do experimento filmado.
Velocidade de reação com comprimidos efervescentes
Depois de realizada a atividade, sugerimos que o professor entregue um texto final que sintetize os aspectos abordados nela. A seguir, disponibilizamos um link com uma sugestão de texto final.
http://pontociencia.org.br/aulas/Cinetica/Atividade_1-1_Texto_Final.docx
Atividade 2 – Relógio de iodo
A seguir, disponibilizamos um link com o roteiro do experimento “Relógio de iodo” e algumas sugestões de exploração do experimento.
http://pontociencia.org.br/aulas/Cinetica/Atividade_1-2_Roteiro.docx
Sugerimos que o professor entregue o roteiro da atividade a seus alunos para que eles realizem o experimento e respondam às questões propostas. Se não for possível realizar o experimento, sugerimos que o professor exiba um vídeo do experimento com um projetor, fazendo pausas nos momentos adequados e repetindo-o sempre que necessário. A seguir, disponibilizamos o link do vídeo, que está disponível no Banco Internacional de Objetos Educacionais (BIOE).
http://objetoseducacionais2.mec.gov.br/handle/mec/14785
Depois de realizada a atividade, sugerimos que o professor entregue um texto final que sintetize os aspectos abordados nela. A seguir, disponibilizamos um link com uma sugestão de texto final.
http://pontociencia.org.br/aulas/Cinetica/Atividade_1-2_Texto_Final.docx
Atividade 3 – Cinética dos gases
A seguir, disponibilizamos um link com o roteiro do experimento “Cinética dos Gases” e algumas sugestões de exploração do experimento.
http://pontociencia.org.br/aulas/Cinetica/Atividade_1-3_Roteiro.docx
Sugerimos que o professor entregue o roteiro da atividade a seus alunos para que eles realizem o experimento e respondam às questões propostas. Se não for possível realizar o experimento, sugerimos que o professor exiba um vídeo do experimento com um projetor, fazendo pausas nos momentos adequados e repetindo-o sempre que necessário. A seguir, disponibilizamos o link do vídeo, que está disponível no BIOE.
http://objetoseducacionais2.mec.gov.br/handle/mec/15338
Depois de realizada a atividade, sugerimos que o professor entregue um texto final que sintetize os aspectos abordados nela. A seguir, disponibilizamos um link com uma sugestão de texto final.
http://pontociencia.org.br/aulas/Cinetica/Atividade_1-3_Texto_Final.docx
Atividade 4 – Reações e taxas
Sobre a simulação Reações e taxas
A simulação pode ser acessada no endereço abaixo.
http://objetoseducacionais2.mec.gov.br/handle/mec/24260
OBSERVAÇÃO: A simulação requer uma versão atualizada do JavaTM.O professor pode verificar isso ao tentar abrir uma simulação. Caso ela não abra, deve-se acessar o endereço <http://www.java.com/pt_BR/> e clicar em Download Gratuito do Java e, em seguida, em Concordar e Inicializar o Download Gratuito. O Professor deve salvar o arquivo de instalação do JavaTM no computador e, então, instalá-lo.
Antes de iniciar a atividade, sugerimos que o professor explore a simulação para saber quais são os seus recursos e como utilizá-los. Para auxiliar nesta tarefa, iremos fazer uma breve explicação sobre o seu funcionamento.
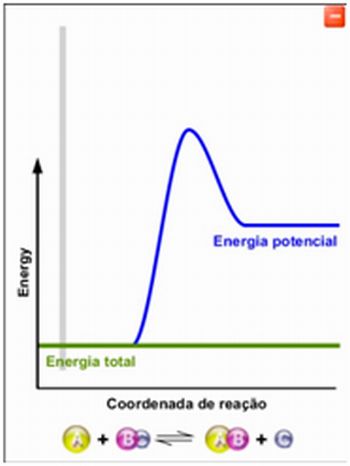
Ao abrir a simulação, aparecerá a imagem abaixo:
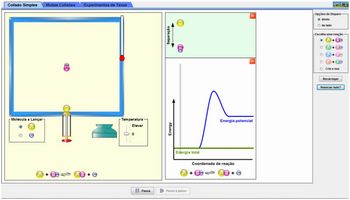
A simulação apresenta três abas diferentes:

Ao abrir a simulação, a aba selecionada é a aba Colisão Simples. Ela representa um recipiente contendo uma molécula de reagente “parada” e um “lançador” de moléculas que pode ser acionado para lançar uma partícula. Basta clicar e arrastar o puxador vermelho. A primeira aba ainda apresenta os seguintes recursos:
| Imagem |
Recurso |
Como Utilizar |
| |
Molécula a lançar |
Selecione a molécula a ser lançada para alterar, também, a molécula a ser atingida. |
| |
Temperatura |
Mova o controle deslizante para aumentar ou diminuir a temperatura do sistema. |
| |
Ver Separação |
Clique no símbolo |
| |
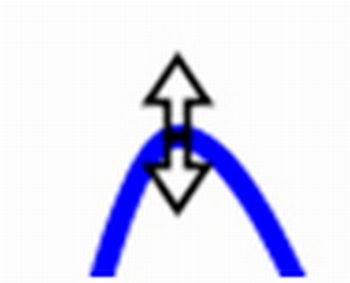
Exibir energia |
Clique no símbolo |
| |
Opção de Disparo |
Selecione "direto" para colisão frontal ou "de lado" para disparar a molécula de forma inclinada (clique e arraste o puxador vermelho para direita ou esquerda). |
| |
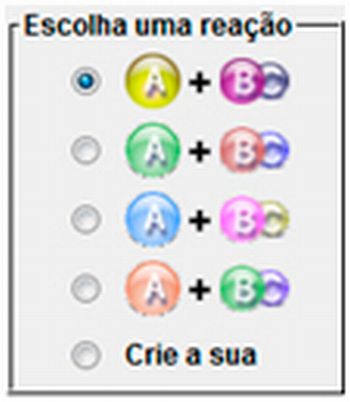
Escolha uma reação |
Selecione a reação a ser trabalhada. Cada reação possui energias de ativação, potencial e total próprias. |
| |
Crie a sua |
Altere os niveis de energia de ativação, potencial e total da sua reação arrastando os controles deslizantes no gráfico (clique em "Exibir energia). |
| |
Pausa |
Pare a simulação em algum momento desejado. |
| |
Passo a passo |
Clique várias vezes para continuar a simulação quadro a quadro. |
| |
Iniciar |
Continue a simulação diretamente. |
| |
Recarregar |
Reinicie a reação. |
| |
Reiniciar tudo? |
Reinicie a simulação. |
A aba “Muitas Colisões” é semelhante à aba “Colisão Simples”, mas, aqui, é possível adicionar várias moléculas de uma mesma espécie dentro do sistema. É possível adicionar moléculas de reagentes ou de produtos. E para adicioná-las ao sistema, é possível proceder de duas formas: utilizando-se a “bomba” que se encontra ao lado do recipiente ou alterando os valores em “Quantidades Atuais”. Para utilizar a bomba, segure e arraste o puxador amarelo que está sobre ela.
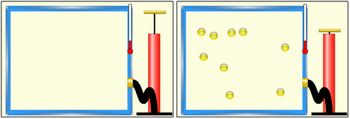
Esta aba ainda apresenta alguns novos recursos:
| Imagem |
Recurso |
Como Utilizar |
| |
Tipo de molécula |
Selecione qual tipo de molécula será adicionado pela bomba |
| |
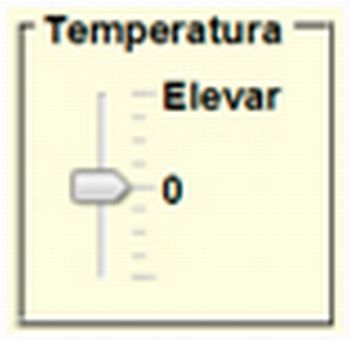
Temperatura inicial |
Mova o controle deslizante para alterar a temperatura inicial do sistema. |
| |
Esvaziar reservatório |
Remove todas as moléculas do reservatório. |
| |
Opções de Gráfico |
Exibe um gráfico que mostra as quantidades de cada molécula no sistema. |
| |
Exibir ligações |
Representa as ligações nas moléculas diatômicas com um traço. |
| |
Exibir cronômetro |
Exibe um cronômetro móvel. |
A simulação ainda apresenta a aba “Experimentos de Taxas”, que não utilizaremos nessa aula.
Trabalhando com a simulação
Para o desenvolvimento dessa atividade, sugerimos, se possível, que o professor leve seus alunos a uma sala de informática para que eles possam manusear a simulação. Caso não seja possível, o professor pode utilizar apenas um computador e um projetor para mostrar a seus alunos o recurso enquanto ele mesmo o manuseia.
A seguir, disponibilizamos um roteiro de exploração da simulação com algumas questões de discussão.
http://pontociencia.org.br/aulas/Cinetica/Atividade_1-4_Roteiro.docx
Sugerimos que o professor entregue esse roteiro a seus alunos para que eles respondam às questões, enquanto exploram a simulação.
Depois de realizada a atividade, sugerimos que o professor entregue um texto final que sintetize os aspectos abordados nela. A seguir, disponibilizamos um link com uma sugestão de texto final.
http://pontociencia.org.br/aulas/Cinetica/Atividade_1-4_Texto_Final.docx
Recursos Complementares
Para abordar alguns aspectos quantitativos a respeito da Cinética das reações químicas, sugerimos uma atividade do portal pontociência chamada Cinetiqueitor/Equilibreitor. É uma atividade com planilhas eletrônicas que aborda aspectos como a lei de velocidade das reações e o tempo de meia-vida. A atividade pode ser acessada no link a seguir.
Para abordar a ideia de etapa determinante das reações químicas, sugerimos um experimento do portal pontociência que propõe um modelo explicativo desse aspecto. O roteiro desse experimento está disponível no BIOE e pode ser acessado no lik a seguir.
http://objetoseducacionais2.mec.gov.br/handle/mec/13547
Para aprofundar a discussão sobre a influência da temperatura nas reações químicas, sugerimos um vídeo do portal pontociência que fala sobre a reação que ocorre em pulseiras ou em bastões que, quando dobrados, liberam luz. Este vídeo está disponível no BIOE e pode ser acessado no link a seguir.
Avaliação
Sugerimos que o professor avalie por meio do desempenho dos alunos e das respostas dadas por eles às questões propostas na atividade.
Cinco estrelas 1 classificações
- Cinco estrelas 1/1 - 100%
- Quatro estrelas 0/1 - 0%
- Três estrelas 0/1 - 0%
- Duas estrelas 0/1 - 0%
- Uma estrela 0/1 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Kamylla, EEMC , Amazonas - disse:
correa.kamylla@gmail.com05/11/2014
Cinco estrelasadorei
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus




 para exibir uma medida qualitativa da separação entre as moléculas.
para exibir uma medida qualitativa da separação entre as moléculas.