25/11/2009
Edson Luis Nunes, Daniel Rodrigues Ventura, Isnard Domingos Ferraz, José Ângelo de Faria.
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Física | Calor, ambiente e usos de energia |
O que o aluno poderá aprender com esta aula
Entender qual o efeito, no estado de um gás perfeito, da ocorrência de variação no valor de mais de uma das suas variáveis de estado.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Temperatura na escala Kelvin, pressão, volume, Lei de Boyle, Lei de Charles e Lei de Charles/Gay-Lussac.
Estratégias e recursos da aula
Depois, pergunte aos alunos se o que foi estudado sobre as Leis de de Boyle, de Charles e de Charles/Gay-Lussac, em geral, é o que acontece na prática, ou seja, se nos sistemas físicos que envolvem gases apenas duas das variáveis sofrerão alteração enquanto uma outra (ou outras) permanecerão constantes. Após ouvir as respostas, cite como exemplo o pistão de um automóvel: quando a faísca da vela detona o combustível, ocorre um súbito aumento de temperatura. Esse aumento de temperatura provoca um aumento de pressão no interior do pistão, que, por sua vez, possui êmbolo móvel. Então o êmbolo se move provocando aumento do volume ocupado pelo gás. Exemplifique também com o funcionamento de uma usina nuclear: o calor esquenta a água (aumento de temperatura), que se transforma em vapor e muda de lugar, aumentando a pressão e volume do sistema, provocando a rotação de uma turbina que, por sua vez, produz energia elétrica.
Pergunte aos alunos agora se eles conseguem dar outros exemplos de sistemas em que as várias variáveis sofrem alteração para que se obtenha um efeito específico. Ouça as respostas e explique-as dizendo se estão corretas e fazendo a associação de cada uma com o estudo que faremos a seguir.
Neste momento, pergunte aos alunos se eles acham que é possível então criar uma equação que relacione essas três variáveis de modo que, caso mais de uma varie, possa se obter o valor da outra. De posse das respostas, escolha a melhor delas e desenvolva, usando as informações da resposta, as deduções adiante:
A Equação de Clapeyron relaciona as três variáveis de estado, pressão, volume e temperatura, para um determinado estado de um gás perfeito. Mas, sabemos que a pressão de um gás é função do choque de suas partículas com as paredes do recipiente que o contém, portanto, é função do número de partículas do gás considerado, ou seja, é função da massa (m) desse gás. Assim, pode-se escrever a Equação 1, sendo (K) uma constante.

(imagem de autoria pessoal)
É de observação experimental que, para gases diferentes, K é inversamente proporcional à massa molar (M) do gás, o que pode ser observado na Equação 2:
E o que é massa molar M? Um mol de um gás constitui-se do número de Avogadro de moléculas desse gás, ou seja 6,02x1023 moléculas/mol. O número (n) de mols de um gás em um recipiente é obtido dividindo-se a massa m desse gás por sua massa molar M, ambos valores de mesma unidade (geralmente gramas). (ver Equação 3)
Portanto, o valor de M é obtido a partir da tabela periódica usada nas aulas de química.
Substituindo a Equação 2 na Equação 1 obtém-se a Equação 4.
Substituindo-se agora a Equação 3 na Equação 4 obtém-se a Equação de Clapeyron.
A constante (R) é chamada de Constante Universal dos Gases Perfeitos e possui os seguintes valores: R = 0,082 atm.L/mol.K ou R = 8,314 joules/mol.K ou R = 1,980 cal/mol.K ou ainda R = 62,400 mmHg.L/mol.K.
Agora, a partir da Equação de Clapeyron pode-se deduzir a Lei Geral dos Gases e dizer que ela relaciona o estado final de um gás com seu estado inicial, em função da variação de mais de uma de suas variáveis de estado.
Seja uma massa m constant e de um de terminado gás perfeito, cujas variáveis de estado inicial são descritas pelos seguintes valores: pi, Vi e Ti. Para esse gás pode-se escrever então como na Equação 5.
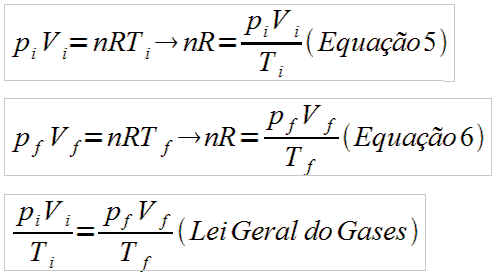
(imagem de autoria pessoal)
Se a massa é constante, o número n de mols desse gás, após a transformação, será o mesmo d e antes. Portanto n também é constante. Considera ndo que na situação
final as variáveis de estado passaram a ter os valores de pf, Vf e Tf, pode-se escrever então como na Equação 6:
Substituindo-se a Equação 5 na Equação 6 tem-se a equação seguinte, chamada de Lei Geral dos Gases, que relaciona estado o final com o estado inicial de um gás perfeito, quando mais de uma de suas variáveis de estado se alteram.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Transformações gasosas | Animação/simulação |
Recursos Complementares
Aprenda mais sobre a Equação de Clapeyron e a Lei Geral dos Gases:
Física.Net: http://www.fisica.net/quimica/resumo17.htm
Dario Leite Resende: http://dlresende.vilabol.uol.com.br/
NEWTON, V.B; HELOU, R.D.; GUALTER, J.B. Tópicos de Física 2 – Termologia, Ondulatória e Óptica. São Paulo: Editora Saraiva, Vol. 2, 448p., 18a Ed., 2007.
Avaliação
Elabore questões teóricas e práticas sobre esse assunto. Nas questões teóricas explore a análise dos gráficos que relacionam o estado final de uma transformação com seu estado inicial. Nas questões práticas explore a equação de Clapeyron sendo usada para se obter as variáveis do estado inicial do gás para, a partir destes dados e da Lei Geral dos Gases, se obter os valores da variáveis do estado final.
Quatro estrelas 3 classificações
- Cinco estrelas 2/3 - 66.67%
- Quatro estrelas 1/3 - 33.33%
- Três estrelas 0/3 - 0%
- Duas estrelas 0/3 - 0%
- Uma estrela 0/3 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
Rafael, SESI , Minas Gerais - disse:
izidoro.rafael85@gmail.com02/01/2016
Cinco estrelasProfessor, existe uma demonstração para a equação geral dos gases, que não dependa da equação de Clapeyron?
-
queones, Pitágoras , Espírito Santo - disse:
queones@gmail.com14/09/2014
Quatro estrelasdidática simples e eficiente, Ótimo!
-
ana claudia telles zancan, portal do professor , Goiás - disse:
anaclaudia-z@hotmail.com13/11/2010
Cinco estrelasparabéns !!! muito bom....exatamente oque precisava♥♥♥
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus



