23/02/2011
Mary Grace Martins (validadora)
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Química | Transformações: caracterização, aspectos energéticos, aspectos dinâmicos |
O que o aluno poderá aprender com esta aula
Após esta aula, o aluno será capaz de:
- Prever e interpretar os efeitos do íon comum e não comum no equilíbrio químico cromato e dicromato.
- Prever e interpretar os efeitos do íon comum e não comum no equilíbrio entre o bicarbonato e o dióxido de carbono.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
O professor deve ter trabalhado previamente com os seguintes assuntos:
- Cinética química, lei da velocidade.
- Equilíbrio químico homogêneo (conceito)
- Fatores que influenciam no equilíbrio químico homogêneo (pressão, temperatura, adição ou remoção de reagentes e produtos).
Estratégias e recursos da aula
A partir da análise dos resultados obtidos na aula "experimento com o equilíbrio entre os íons cromato e dicromato" (http://portaldoprofessor.mec.gov.br/fichaTecnicaAula.html?aula=18737), apresente as equações que descrevem o equilíbrio em cada experimento realizado na aula anterior no quadro negro e proponha as perguntas de interpretação abaixo aos alunos. Neste momento é hora de formalizar os conhecimentos. Como tratam-se de equações complexas, faça a resolução com a ajuda deles, solicitando a opinião dos alunos a cada etapa da construção da resposta.
1º Experimento
Considere o seguinte equilíbrio em meio aquoso:
2 CrO42-(aq) + 2 H+(aq) <--> Cr2O72-(aq) + H2O(l)
AMARELO ALARANJADO
a) O que foi observado após a adição de solução 1 mol/L de hidróxido de sódio a solução de dicromato de potássio? Qual a explicação para esta mudança?
Observou-se o efeito do íon não comum, OH- proveniente da base adicionada, que reage com o íon H+ e desloca o equilíbrio para esquerda, o qual favorece a formação de CrO4-2 que tem coloração amarela.
b) O que foi observado após a adição de solução 1 mol/L de ácido clorídrico a solução de dicromato de potássio? Qual a explicação para esta mudança?
Observou-se a volta da coloração alaranjada. Isto deve-se ao fato do efeito do íon comum, H+, que desloca o equilíbrio para direta, promovendo a formação de Cr2O7-2 que possui coloração alaranjada.
c) Associe cada ação (adição de ácido e de base) ao efeito do íon comum e efeito do íon não comum.
Adição de base: efeito do íon não comum: OH-
Adição de ácido: efeito de íon comum: H+
2º Experimento
Considere o seguinte equilíbrio em meio aquoso:
HCO3-(aq) + H+(aq) <--> CO2(g) + H2O(l)
Explique por que ocorre efervescência quando se adiciona ácido ao bicarbonato, mas não ocorre desprendimento de gás quando se adiciona base.
A efervescência ocorre apenas com a adição de ácido, pois com aumento da concentração de H+ pela adição de ácido (efeito do íon comum), o equilíbrio químico é deslocado para a direta, promovendo a adição do gás CO2, responsável pela efervescência. Já na adição de base promove-se a diminuição da concentração de íons H+ pela presença dos grupos OH- provenientes da base (efeito do íon não comum) deslocando o equilíbrio para esquerda, não favorecendo a formação de CO2.
Uma forma alternativa de verificar o efeito do deslocamento de equilíbrio é visualizar o deslocamento do equilíbrio químico do íon bicarbonato através da mudança na coloração de uma solução contendo fenolftaleína, atividade proposta no seguinte vídeo:
Questões semelhantes as que foram feitas acima para os experimentos da aula "experimento com o equilíbrio entre os íons cromato e dicromato" (http://portaldoprofessor.mec.gov.br/fichaTecnicaAula.html?aula=18737) podem ser feitas para a experiência acima indicada, como atividade a fim de evidenciar o grau de compreensão dos alunos.
Após esta explanação, proponha aos alunos responderem seguinte situação problema inédita. Somente se, diante de uma situação nova, os alunos aplicarem os conhecimento adquiridos é que poderemos verificar se realmente houve compreensão.
---------------------------------------------------------------------------------------------------------------------------------------------
O pH do sangue, em condições normais, varia de 7,35 a 7,45 e é mantido nesta faixa principalmente devido à ação do sistema H2CO3/HCO3-, cujo equilíbrio pode ser representado por:
CO2(g) + H2O(l) <--> H2CO3(aq) <--> H+(aq) + HCO3-(aq)
Em determinadas circunstâncias, o pH do plasma pode sair desta faixa. Considere as situações:
I – histeria, ansiedade ou choro prolongado, que provocam respiração rápida (hiper-ventilação);
II – confinamento de um indivíduo em um espaço pequeno e fechado
III – administração endovenosa de uma solução de bicarbonato de sódio, NaHCO3.
Para cada situação, preveja o que acontecerá com o pH do sangue em cada circunstância:
I. ( x ) aumenta ( ) diminui
II. ( ) aumenta ( x ) diminui
III. ( x ) aumenta ( ) diminui
---------------------------------------------------------------------------------------------------------------------------------------------
Chame a atenção dos alunos que há uma correlação de dois equilíbrios e que, alterando-se a concentração de um, o outro equilíbrio também será afetado.
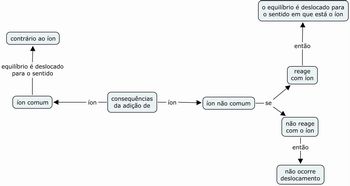
Por fim, com o objetivo de verificar a aprendizagem dos alunos, após construir com eles as respostas acima, proponha aos alunos que façam mapas conceituais dos deslocamentos do equilíbrio, tentando prever as várias possibilidades de variação das concentrações dos componentes e os efeitos no equilíbrio dos íons comuns e não comuns. Pode-se utilizar o programa Cmap Tools (http://cmap.ihmc.us/conceptmap.html), disponível de forma gratuita e com um tutorial (http://penta2.ufrgs.br/edutools/tutcmaps/tutindicecmap.htm) bastante fácil. Recolha e entregue com as eventuais correções e solicite que eles refaçam e mandem novamente. Repita esta última ação até que todos os mapas fiquem corretos. Um exemplo de mapa conceitual encontra-se abaixo:
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Equilíbrio Químico da amônia: Efeito do Íon comum: Parte 1: experimento prático | Experimento prático |
Recursos Complementares
Video com demonstração experimental para o equilíbrio cromato e dicromato: http://www.youtube.com/watch?v=Kn93VdJbmvM
Video com demonstração da reação do bicarbonato de sódio com vinagre e o desprendimento de gás gerado: http://www.youtube.com/watch?v=YSOAOE6NieY
Avaliação
Uma forma de verificar a aprendizagem é fazê-los escrever uma descrição sobre os deslocamentos utilizando uma línguagem química, tentando explicar o porquê que os fenômenos ocorreram. Durante a construção coletiva, você pode verificar se o aluno está apropriando-se da linguagem química ou não. Desta forma, você professor(a) poderá verificar o aprendizado de seus alunos. Indique a ele as partes falhas e peça para eles refazerem o parágrafo explicativo até ficar de acordo com as respostas modelos indicadas na seção "estratégias e recursos" desta aula. Os mapas, ao serem recolhidos, devem ser avaliados, observando os critérios de criatividade, lógica e abrangência.
Três estrelas 2 classificações
- Cinco estrelas 0/2 - 0%
- Quatro estrelas 0/2 - 0%
- Três estrelas 2/2 - 100%
- Duas estrelas 0/2 - 0%
- Uma estrela 0/2 - 0%
Denuncie opiniões ou materiais indevidos!
Opiniões
-
victor fonseca, PUC , São Paulo - disse:
victor.pucsp@gmail.com06/07/2014
Três estrelasInteressante!
-
graça, UNP Natal , Rio Grande do Norte - disse:
gracabio@bol.com.br29/10/2011
Três estrelasConsiderei a aula com um bom nível de objetividade.
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus