06/10/2011
Daniel Rodrigues Ventura e Edson Luís Nunes
| Modalidade / Nível de Ensino | Componente Curricular | Tema |
|---|---|---|
| Ensino Médio | Física | Calor, ambiente e usos de energia |
| Educação de Jovens e Adultos - 2º ciclo | Ciências Naturais | Visões de mundo |
O que o aluno poderá aprender com esta aula
- Identificar as grandezas que envolvem o estado físico de um gás ideal.
- A relação matemática entre as grandezas que envolvem a pressão, o volume e a temperatura de um gás ideal.
- A solucionar exercícios envolvendo as grandezas que caracterizam o estado de um gás ideal.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Temperatura, calor, pressão.
Estratégias e recursos da aula
Sugerimos que o professor inicie a aula fazendo algumas exposições demonstrativas simples, mas que fornece uma informação adequada ao conteúdo que se pretende repassar aos alunos.
Atividade I
Material:
- Um balão de borracha.
- Uma seringa grande sem a agulha.
Procedimento:
- Assopre o balão enchendo-o parcialmente e depois deixe o ar sair. Repita isso pelo menos por três vezes para as paredes de balão se tornar bem flexível, menos rígida.
- Deixe sair boa parte do ar isolando apenas uma pequena parte formando um pequeno balão que deverá caber dentro da seringa, esquema B da Figura 01.
- Amarre um barbante isolando a parte cheia de ar, balãozinho, e corte as sobras da borracha, esquema C.
- Retire o êmbolo da seringa e coloque o balãozinho dentro da seringa. Veja que o diâmetro do balãozinho deve ser um pouco menor que o diâmetro da seringa, ou seja, ele cabe com folga dentro da seringa, esquema D, Figura 01.
- Tampe a extremidade da seringa com o dedo e empurra o êmbolo da seringa pressionando o ar dentro da seringa, esquema E da figura.
- Ainda com o dedo vedando a saída de ar na seringa, puxe o embolo para fora diminuindo a pressão no interior da seringa, esquema F, Figura 01.
Repita os procedimentos 5 e 6 várias vezes em diversos pontos da sala para que todos os alunos possam acompanhar e observar, sempre pedindo para notarem o que acontece com o balão no interior da seringa.
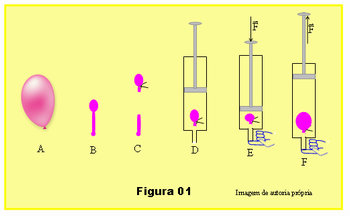
O professor deverá explicar aos alunos que o comportamento do balão corresponde ao comportamento do gás em seu interior; o uso do balão é para se tornar mais perceptivo aquilo que ocorre com o gás no interior da seringa, e que praticamente não houve variação temperatura no interior do balão.
Em seguida, pergunte para que respondam oralmente:
O que acontece com o volume do balão quando forçamos o êmbolo comprimindo o ar dentro da seringa?
E quando puxamos o êmbolo para fora, diminuindo a pressão no interior da seringa?
Então, que relação deve existir entre a pressão e o volume de um gás?
- Deverão ter observado que aumentando a pressão o volume diminui e diminuindo a pressão o volume do balão aumentou. Certamente dirão que o volume é inversamente proporcional à pressão.
Atividade II
Depois faça a seguinte exposição:
Material:
- Um balão de borracha.
- Uma garrafa vazia.
- Uma vela ou um recipiente com água quente ou morna.
Procedimento:
- Adquira uma garrafa vazia, assopre o balão enchendo-o de ar. Esvazie o balão e encha-o novamente, repetindo esse procedimento pelo menos três vezes, para a borracha do balão se tornar menos rígida.
- Adapte a boca do balão vazio, no gargalo da garrafa, veja esquema B da Figura 02.
- Coloque a garrafa dentro de um recipiente com água quente, esquema C na Figura 02, ou coloque o fundo da garrafa sobre a chama de uma vela, esquema D desta figura.
Faça esse procedimento na mesa da sala de aulas ou em uma posição que todos possam observar. Se necessário repita o procedimento algumas vezes para grupos menores, é importante que todos estejam atentos e observem o que está acontecendo.
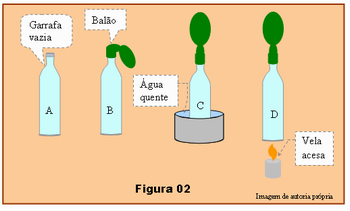
Pergunte novamente para a turma responder oralmente.
Ao aquecer o ar dentro da garrafa o que aconteceu com seu volume?
A pressão externa aumentou ou diminuiu?
Então, sobre pressão constante como o volume de um gás se relaciona com sua temperatura?
- Ao aumentar a temperatura colocando a garrafa dentro da água morna ou sobre a chama quente de uma vela, o balão encheu, ou seja, o ar dentro da garrafa sofreu dilatação enchendo o balão. A pressão praticamente permaneceu constante, pois encheu pouco o balão quase sem forçar suas paredes. Disto conclui-se que o volume varia diretamente com a temperatura.
Faça também a demonstração da prática experimental esquematizada na Figura 03.
Material:
- Uma garrafa vazia
- Uma rolha de cortiça, ou de borracha ou de plástico, que se adapte a boca da garrafa.
- Cerca de 80 cm de uma mangueira bem fina e transparente.
- Um pouco de água colorida com tinta ou anilina.
- Uma vela de parafina.
Procedimento:
- Fure a rolha fazendo um orifício em seu centro tal que a mangueira passe através dele, mas de maneira bem justa. Coloque a rolha na boca da garrafa que também deve ficar bem justa, bem apertada, esquema a da Figura 03.
- Antes de adaptar a mangueira à rolha, dobre-a próximo do ponto médio mantendo as duas extremidades abertas para cima. Coloque tinta ou anilina em um pouco de água e introduza a água colorida na mangueira até que fiquem aproximadamente 15 cm de altura de cada lado da mangueira, veja esquema B da figura. Se necessário use a seringa para facilitar a introdução da água na mangueira.
- Introduza então uma das extremidades da mangueira no orifício da rolha da garrafa, mantenha a outra extremidade também para cima, esquema C da figura. Se necessário prenda a outra extremidade com uma fita aderente ou pedaço de barbante no bico da garrafa ou use um suporte. Acenda uma vela e com a parafina vede bem a rolha para não escapar ar.
- Aqueça a garrafa com cuidado para a água não transbordar. Se as paredes da garrafa forem bem finas, basta atritá-la um pouco com um papel toalha ou esfregando as mãos e colocando as palmas em contato com a garrafa, se necessário use a chama da vela; peça aos alunos para observarem o que acontece com a água na mangueira à medida que se aquece a garrafa.
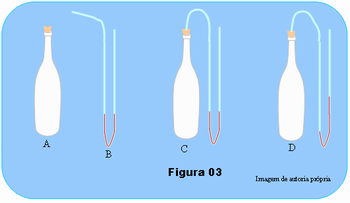
Argumente com os alunos que o volume do gás confinado na garrafa, praticamente não sofre alteração; a variação do volume na mangueira é desprezível, pois, ela deverá ser muito fina.
Depois pergunte sobre esta apresentação:
Como era a pressão do ar dentro da garrafa antes de aquecer a garrafa?
E depois que a garrafa foi aquecida?
Que relação deverá existir entre a pressão e a temperatura com volume constante?
- Deverão dizer que a pressão na garrafa antes do aquecimento era igual a pressão atmosférica, pontos de um mesmo nível de um mesmo fluido. Após aquecimento a pressão no interior da garrafa aumentou, verificado pelo desnível da coluna de água nos dois ramos da mangueira. Conclui-se então que a pressão variou diretamente com a temperatura.
Atividade III
Depois o professor poderá exibir aos alunos o seguinte filme disponível na internet com o seguinte título e endereço:
Gás ideal Equação de Clapeyron
http://www.youtube.com/watch?v=08-GKwQNpAc
Acesso em 05/09/2011.
Depois de comentar o filme, reforçar com os alunos a equação de Clapeyron e o que é um gás ideal.
Equação de Clapeyron: PV = nRT, em que: P é a pressão exercida obre o gás; V é o volume ocupado pelo gás; T é a temperatura Kelvin que se encontra o gás; n é o número de moles do gás e R é a constante universal dos gases.
Gás ideal:
É um gás hipotético, um modelo físico-matemático criado para explicar o comportamento macroscópico de um gás. Este modelo prevê que num gás ideal:
- As moléculas têm massa não nula, mas seu volume é desprezível;
- As moléculas não se atraem e nem se repelem, por isso só há interação entre elas quando se chocam;
- As colisões entre as moléculas são completamente elásticas e o tempo de interação é desprezível;
- Entre duas colisões sucessivas, as partículas estão sempre em movimento retilíneo uniforme e obedecem as leis da Mecânica Newtoniana;
- O gás, nestas circunstâncias, pode ser definido pelas suas variáveis macroscópicas de estado: V, P e T.
Para certos valores de pressão e temperatura, pressão mais baixa e temperaturas mais altas, as leis dos gases ideais se aplicam à maioria dos gases reais com grande aproximação, principalmente para os monoatômicos.
A partir daí peça aos alunos que através da equação de Clapeyron, mostre as relações das seguintes transformações de certa massa de um gás ideal:
- Lei de Boyle-Mariotte, transformação isotérmica.
- Lei de. Charles e Gay Lussac, transformação isobárica.
- Lei de Charles, transformação isométrica ou isovolumétrica ou isocórica.
- De PV = nRT, tem-se que PV/T = nR; nR é constante.
- Pode-se então escrever: P1V1/T1 = P2V2/T2
- 1. Se T não varia, T1 =T2;
- P1V1 = P2V2 ou PV = const. ( Lei de Boyle-Mariotte)
- 2. Se P não varia, P1 = P2
- V1/T1 = V2/T2 ou V = const.T (Lei de Charles e Gay Lussac)
- 3. Se V não varia, V1 = V2
- P1/T1 = P2/T2 ou P = const.T (Lei de Charles)
Atividade IV
Se houver tempo disponível da aula, o professor poderá elaborar alguns exercícios para os alunos individualmente ou em grupos aplicarem o conteúdo trabalhado.
Exemplos:
1. Um balão de 200 litros contém gás hélio, à temperatura de 27°C e pressão de 2,0.105 Pa. Determine o número de moles contidos no balão considerando o comportamento do hélio como um gás ideal e massa atômica de 4 u.a., a constante universal dos gases é R = 8,31 J/mol.k.
2. Um motorista calibra os pneus de seu carro com pressão de 30 lib/(pol)2 de manhã, quando a temperatura era de 7oC. Após rodar no asfalto por algum tempo, a temperatura dos pneus atingira uma temperatura de 27oC. Desconsiderando a dilatação dos pneus, qual deverá ser a pressão no interior dos mesmos?
1. Aplicando a equação de Clapeyron:
· PV = nRT; 200 litros = 200.10-3 m3 = 0,200 m3 e 20oC = 300K
· 2.105.0,200 = n.8,31.300 (Unidades no SI)
· n = 16
2. Transformação isométrica:
· P1/T1 = P2/T2
· P1.T2 = P2.T1
· 30.300 = P2.280
· P2 = 32,14 libras/(pol)2
Para reforçar o conteúdo, ao final da aula ou em outro horário de suas aulas, o professor poderá fazer uma revisão utilizando uma animação sobre propriedades dos gases, acessando o link, a seguir, e apresentando essa animação para a turma. Mostre a eles como as opções de P, V, T (Pressão, volume e temperatura) e o número de partículas, bem como a quantidade de calor, Q, podem ser controlados na simulação. Fixe o valor de algumas grandezas, mantendo duas variando para mostrar como essas relacionam entre si, isoladamente.
Havendo recurso disponível, distribua a turma em duplas e orientem para que possam utilizar essa animação.
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Propriedades dos gases | Animação/simulação |
Recursos Complementares
Sugerimos que o professor acesse os seguintes endereços abaixo:
Propriedades dos gases
http://portaldoprofessor.mec.gov.br/fichaTecnica.html?id=10386
http://www.if.ufrgs.br/public/tapf/v19n5_Michelena_Mors.pdf
Avaliação
Para complementar o assunto, oriente os alunos para fazerem uma pesquisa, individualmente ou em grupos, sobre a lei de Dalton, referente à mistura de gases ideais. Peça também para descrever a lei de Avogadro. Depois, durante certo momento em outra aula de Física, entregar e discutir o trabalho de pesquisa realizado.
Sem estrelas 0 classificações
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncie opiniões ou materiais indevidos!
- Sugestão de aula
- Aulas
- Coleções de aulas
- Criar aula
- Criar individual
- Criar em equipe
- Gerenciar equipes
- Minhas aulas
- Orientações
- Criando equipes
- Dicas para a produção de aulas
- Reflexões pedagógicas
- Utilizando a ferramenta
- Artigo: portal educacional
- Estatísticas de uso do Portal
- Estatísticas de aulas
- Estatísticas de recursos
- Estatísticas de visitas
- Recursos utilizados em aulas
- Reflexões pedagógicas
- Informações de cursos
- Cursos
- e-Proinfo
- Materiais de cursos
- Materiais de estudo
- Artigos e publicações
- Assuntos relevantes
- Avaliações
- Ciência do cotidiano
- Destaques internacionais
- Dicas práticas
- Educação profissional e tecnológica
- Entrevistas
- Estratégias pedagógicas
- Inovações tecnológicas
- Materiais de cursos
- Materiais de evento
- Orientações e diretrizes
- Parâmetros e referencias
- Programas em vídeos
- Tutoriais
- TVescola
- Ferramentas do portal
- Fórum
- Portal do Youtube
- Compartilhando apresentação
- Ferramentas pela internet
- Blog
- Compartilhe vídeos
- Comunicação on-line
- Crie e compartilhe apresentações
- Edite e compartilhe fotos
- Escrita colaborativa
- Junte-se a uma comunicade
- Lista de discussão
- Organize e compartilhe favoritos
- Podcast
- Rádio/TVs Universitárias e outros
- Redes Sociais
- Robô Ed
PLATAFORMA FREIRE
- Bibliotecas
- Capacitação Proinfo Integrado
- Cultura
- Dicionários, tradutores e enciclopédias
- Educação inclusiva
- Geoprocessamentos
- Inclusão digital
- Infográficos
- Jogos educativos
- Jornais
- Museus
- Observatórios e planetários
- Organizações governamentais
- Plataformas educacionais
- Portais educacionais e outros
- Portal MEC
- Prêmio professores do Brasil
- Produções de professores
- Projetos de escolas
- Projetos inovadores
- Projetos sociais e educacionais
- Rádio escola
- Recursos digitais
- Revistas
- Sites de busca
- Sites temáticos do portal e TVescola
- Softwares de edição e outros
- Softwares educacionais
- Um computador por aluno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


