21/09/2011
Daniel Rodrigues Ventura e Edson Luís Nunes
| Modalidad / Nivel de Enseñanza | Disciplina | Tema |
|---|---|---|
| Educação de Jovens e Adultos - 2º ciclo | Ciências Naturais | Visões de mundo |
| Ensino Médio | Física | Calor, ambiente e usos de energia |
O que o aluno poderá aprender com esta aula
- As características dos estados físicos ou fase da matéria.
- As transformações de um estdo físico para outro sofrido por uma substância.
- Certificar que a temperatura de uma substância não varia durante o processo de mudança de fase.
Duração das atividades
Conhecimentos prévios trabalhados pelo professor com o aluno
Calor, temperatura, dilatação.
Estratégias e recursos da aula
Sugerimos que o professor inicie sua aula interrogando aos alunos se eles sabem quais são os estados físicos da matéria? Peça também que dê exemplos de alguma substância ou objeto com o respectivo estado físico que se encontra, nas condições do ambiente em que se encontram.
Em seguida apresente para eles a Figura 01 e explique que a matéria no nosso meio se apresenta principalmente em uma das fases ou estados físicos, quase sempre perceptíveis pelos nossos sentidos. Nessa figura estão ilustradas as três fases presentes numa xícara com café quente: Sólida, a porcelana da xícara, fase Líquida está o café e fase gasosa os vapores saindo da xícara.
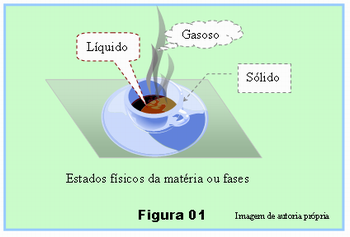
Depois o professor deverá falar sobre a situação de agregação das partículas em cada uma dessas fases ou estados físicos.
· No estado sólido, as partículas que constituem o objeto ficam muito próximas umas das outras, por isso, um sólido tem forma própria e volume definido em condições do ambiente.
· No estado líquido, de uma maneira geral, as partículas, moléculas, estão um pouco mais afastada que no estado sólido, então as partículas tem certo grau de liberdade podendo se deslocar dentro da massa do líquido. É devido a isso que os líquidos não possuem forma própria embora tenha um volume definido nas condições do ambiente.
· Na fase gasosa, as partículas, átomos ou moléculas estão bem afastados uns dos outros, por isso tem mais liberdade de movimentação, não tendo nem volume nem forma própria tendendo ocupar todo o espaço disponível.
Atividade I
Em seguida o professor deveria explicar que uma substância pode passar de um estado físico para outro desde que seja alterada alguma condição em que está submetida.
Faça o seguinte questionamento para responderem individual e oralmente: escolha alguns que se manifestarem em responder e após ouvir algumas respostas, faça comentários que julgarem convenientes, encaminhando a solução para que cada um possa registrar em suas anotações.
Que grandeza física faz com que as partículas de um sistema ou de uma substância se afastam?
- Certamente lembrando do conceito de temperatura e dilatação dirá que é o aumento de temperatura. Se necessário, o professor deverá fazer com que relembrem disso.
Ao aumentar somente a temperatura de um sólido fornecendo calor a ele o que deverá ocorrer com os espaços entre suas partículas?
- Essa pergunta é praticamente a resposta da primeira ou vice-versa. É apenas para forçar o aluno a pensar um pouco. O aumento da temperatura de um corpo provoca o aumento dos espaços entre as partículas.
Se continuarmos a fornecer calor aumentando sua temperatura o que se deve esperar em um determinado limite?
- A distancia aumentará até um limite em que o sólido passará para a fase líquida.
Se tiverem dificuldades em responder esse questionamento, o professor deverá fazer um diálogo com os alunos de modo intuitivo a fim de encaminhar à conclusão da resposta.
Em seguida o professor deverá apresentar o esquema ilustrado na Figura 02, desenhando o esquema no quadro ou projetando a figura em uma tela, na própria sala de aulas. Deverá então falar sobre cada transformação indicada no esquema da figura, inclusive sobre a troca de calor com o meio, ou seja, nas transformações cujas setas, no esquema da Figura 02, apontam para a direita a substância absorve calor durante a transformação de fase; nas transformações cujas setas, no esquema da figura, apontam para a esquerda a substancia cede calor durante a transformação de fase.
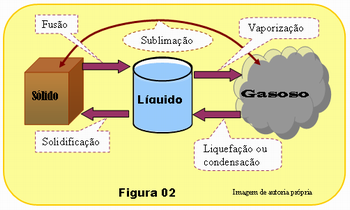
Atividade II
Depois o professor poderá fazer a seguinte demonstração experimental na sala de aulas.
Material:
- Um termômetro.
- Um béquer ou recipiente transparente de vidro pirex.
- 6 a 8 bloquinhos de gelo.
- Uma chama quente, gás ou vela.
Procedimento:
Pegue cerca de 8 bloquinhos de gelo diretamente do congelador da geladeira ou prepare o gelo com antecedência colocando água na forma de fazer gelo ou coloque cerca de 30 ml de água num copinho plástico, desses usados para tomar café e coloque no congelador da geladeira.
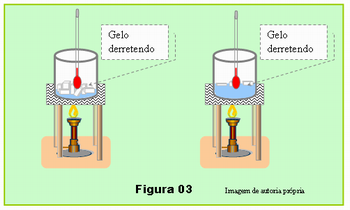
Na hora de iniciar o experimento, coloque o béquer sobre um suporte e coloque 6 a 8 bloquinhos de gelo nele. Coloque um termômetro com o bulbo no meio do gelo. Para agilizar o processo da fusão do gelo, acenda uma chama sob o béquer, esquema à esquerda da Figura 03. Se for usar a chama de vela, use mais de uma chama para aquecer e derreter o gelo mais rápido.
Assim que o gelo começar a fundir, derreter, e a temperatura indicada pelo termômetro se mostrar estável, chame os alunos para que individualmente e de maneira ordenada, anotem o valor da temperatura, escrevendo-o numa folha ou no caderno. Faça então uma pausa até que cerca da metade do gelo sofra fusão; peça novamente aos alunos para checarem e anotarem a temperatura.
A leitura observada poderá ser zero ou um valor próximo ao 0oC; esse depende de muitos fatores, como pressão local, precisão do termômetro, o gelo proveniente de água não pura.
Depois de realizada as duas leituras faça a seguinte pergunta:
Que temperatura você observou no termômetro quando se iniciou a fusão do gelo? E quando praticamente todo o gelo se derreteu?
- Devem ter observado o mesmo valor nas duas leituras, se houve pequena diferença nos valores, o professor deve explicar que pode ser erros de leitura e considerar essa diferença desprezível para a ocasião. O professor obviamente estará atento a essa leitura durante todo o tempo, para se for o caso, certificar se algum aluno cometeu erro de leitura.
Durante a fusão o gelo absorveu calor? Como você comprova que houve essa absorção?
- Certamente absorveu. Ele observou a chama acesa cedendo calor para o recipiente de gelo; ele pode também alegar que a temperatura do gelo sendo menor, o gelo absorve calor.
O professor então deve explicar que o importante neste experimento é observar que, enquanto o gelo está derretendo, sua temperatura não varia. Assim, durante a fusão do gelo, ele absorve calor e sua temperatura não varia.
Defina então calor latente(L).
O calor latente (L), de uma substância, é a quantidade de calor (Q) absorvida ou cedida pela substância por unidade de massa (m), sem haver alteração na temperatura da substância. O calor latente ocorre normalmente durante a transição de fases, sendo um valor característico da substância. L = Q/m.
Atividade III
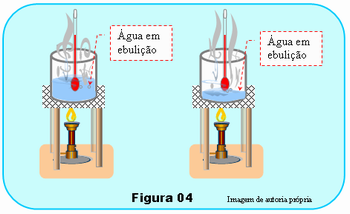
Em seguida o professor poderá fazer outra prática demonstrativa como ilustrada no esquema da Figura 04.
Material:
- Um béquer de 300 a 500 ml ou um recipiente de vidro resistente ao calor, vidro pirex, por exemplo.
- Um termômetro.
- Uma chama de gás ou velas.
- Suporte para o recipiente de vidro.
Procedimento:
Coloque água até aproximadamente à metade do recipiente e coloque o recipiente sobre o suporte. Acomode o bulbo do termômetro dentro da água sem que ele toque o fundo do recipiente, use um suporte para ele se necessário. Acenda a chama de gás sob o suporte, se usar a chama de velas utilize pelo menos 3 velas para que não demore muito para aquecer a água. Para ganhar tempo, sendo possível, coloque a água quente ou morna no recipiente para que ela entre em ebulição em menos tempo.
Ao passo que a água entrar em ebulição, começar a ferver, peça novamente aos alunos para que individualmente e de maneira ordenada, anotem o valor da temperatura, escrevendo-o numa folha ou no caderno. Faça então uma pausa de cerca de três minutos para que anotem a temperatura da água de novo.
Pergunta a eles o que perceberam de semelhante entre a fusão do gelo e a ebulição da água?
Certamente vão concluir que, da mesma maneira que ocorreu durante a fusão do gelo, durante a ebulição da água não houve alteração de sua temperatura.
O professor então deverá explicar que o calor absorvido pela substância durante a fusão é denominado de calor latente de fusão e durante a ebulição de calor latente de vaporização. Assim como o calor cedido durante uma solidificação é o calor latente de solidificação, etc. Que para uma mesma substância, sob mesma pressão, o calor latente de fusão tem o mesmo valor do calor latente de solidificação. Assim como o calor latente de vaporização é igual em valor ao calor latente de condensação.
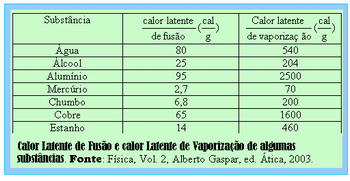
Abaixo, apresentamos uma tabela dos valores do calor latente de fusão e de vaporização de algumas substâncias sobre pressão de 1,0 atm.
Peça aos alunos que individualmente calculem a quantidade de calor que deve ser fornecido a 1,0 kg de gelo, sob pressão de 1,0 atm, apenas para transformá-lo em água?
· Usando a definição de calor latente, L = Q/m, tem-se que Q = mL. m = 1,0 kg =1000g e L = 80 cal/g, veja a tabela.
· Q = 1000g.80cal/g
· Q = 8,0.104 cal
Se ao final da aula o professor desejar fazer um reforço do conteúdo da aula, poderá acessar e apresentar aos alunos o laboratório virtual, disponível em:
Recursos Educacionais
| Nome | Tipo |
|---|---|
| Calorimetria - Mudanças de Estado Físico | Animação/simulação |
Recursos Complementares
Acesse o site abaixo:
Avaliação
O professor poderá elaborar exercícios para aplicação do conteúdo da aula afim de que os alunos resolvam em equipes para serem apreciados durante outro horário de aulas. Como sugestão segue o seguinte exercício:
Uma senhorita queria perder 5 kg de sua massa corporal em apenas 15 dias. Seguia ao pé da letra as metas traçadas pela sua nutricionista até que no oitavo dia de sua penitência não resistiu às tentações e comeu uma barra de chocolate. Verificou que a barra de chocolate usado tinha 232 kcal. Com peso na consciência resolveu descobrir uma maneira de anular o excesso de calorias que seriam convertidos em seu organismo. Teve o seguinte raciocínio. Se chupasse gelo a 0oC ingerindo a água resultante, o gelo e a água absorveriam calor do organismo, temperatura mais alta, e assim anularia a quantidade de calor adicionada ao organismo pela ingestão da barra de chocolate.
Supondo o raciocínio correto, considerando 36oC a temperatura do corpo, calcule quantos gramas de gelo deveria esta senhorita usar para anular os 232 kcal a mais em sua dieta.
Sem estrelas 0 calificaciones
- Cinco estrelas 0/0 - 0%
- Quatro estrelas 0/0 - 0%
- Três estrelas 0/0 - 0%
- Duas estrelas 0/0 - 0%
- Uma estrela 0/0 - 0%
Denuncia opiniones o materiales indebidos!
- Sugerencias de clases
- Clases
- Colecciones de clases
- Crear clase
- Crear individual
- Crear em equipo
- Accede tus equipos
- Mis clases
- Orientaciones
- Creando equipos
- Pistas para producción de clases
- Reflexiones pedagógicas
- Utilizando la herramienta
- Artículo: portal educacional
- Estadísticas de uso del Portal
- Clases Estadísticas
- Estadísticas de recursos
- Estadísticas de visitas
- Recursos utilizados en las clases de
- Reflexiones pedagógicas
- Informaciones de cursos
- Cursos
- e-Proinfo
- Materiales de curso
- Materiales de estudio
- Artículos y Publicaciones
- Asuntos relevantes
- Opiniones
- Ciencias de la vida cotidiana
- Destaca Internacional
- Consejos prácticos
- La educación profesional y tecnológica
- Entrevistas
- Estrategias pedagógicas
- Las innovaciones tecnológicas
- Los materiales del curso
- Acontecimiento Materiales
- Directrices y directivas
- Parámetros y referencias
- Programas en los vídeos
- Tutoriales
- TVescola
- Cuadernos didáticos
- Colecciones de recursos
- Recursos educacionales
- Sitios temáticos
- Tv escuela en vivo
- Herramienta del portal
- Foro
- Portal em Youtube
- Compartiendo presentaciones
- Herramientas por internet
- Blog
- Compartir videos
- La comunicación en línea
- Crear y compartir presentaciones
- Editar y compartir fotos
- Escritura colaborativa
- Únete a una comunicade
- Hilo
- Organizar y compartir tus favoritos
- Podcast
- Radio / TV y otra universidad
- Redes Sociales
- Robot Ed
PLATAFORMA FREIRE
- Bibliotecas
- Proinfo integrado de capacidad
- cultura
- Diccionarios, traductores y enciclopedias
- La educación inclusiva
- Geoprocessamentos
- La inclusión digital
- Infografía
- Juegos educativos
- Periódicos
- Museos
- Observatorios y planetarios
- Organizaciones gubernamentales
- Las plataformas educativas
- Portales educativos y otros
- MEC Portal
- Profesores Premio de Brasil
- Producciones de los docentes
- Proyectos de Escuelas
- Proyectos innovadores
- Los proyectos sociales y educativos
- Escuela de Radio
- Recursos digitales
- Revistas
- Búsqueda Sitios
- Sitios portal temático y TVescola
- Software de edición y otros
- Software educativo
- Un ordenador por alumno

- Ryan Oksenhorn
- Ryan Snow
- Sergio Caldara
- Shane Miler
- Shane Herzog
- Sotirios Papavasilopoulos
- Stephen JB Thomas
- Tarah
- Valera Nazarov
- ZbigniewMa K Flakus


